Não sabe nada de equilíbrio químico? Não se desespere! Ao ler esse post até o final, você jamais errará uma questão de equilíbrio novamente! Nesse texto, te ajudamos a descomplicar qualquer tipo de questão de equilíbrio sabendo poucas informações.

Vamos beber nessa fonte de conhecimento que é a latinha de… Ciência?
Equilíbrio químico é a parte da físico-química que estuda as reações reversíveis. Mas o que isso significa?

Reação reversível é aquela na qual ocorrem duas reações simultaneamente: os reagentes se transformando em produtos e os produtos se transformando em reagentes. Epa! Peraí! Então isso significa que uma hora os reagentes param de reagir formando os produtos e vice-versa?

NÃO!
Uma reação reversível não chega ao final NUNCA! Os reagentes constantemente se transformam nos produtos e os produtos constantemente se transformam em reagentes. O gráfico principal de estudo nesse caso é o gráfico que apresenta essa aparência:
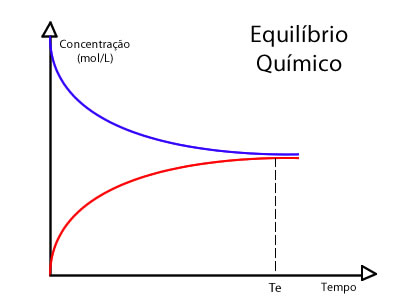
No gráfico, o T é o tempo necessário para que a reação entre em equilíbrio; a coloração azul significa o gráfico de consumo dos reagentes; e a coloração vermelha significa o gráfico de formação dos produtos.

Você consegue observar que, a partir do T, a concentração dos reagentes e dos produtos praticamente não varia? Isso significa que a reação entrou em equilíbrio! Difícil? Outra maneira de falar que a reação entrou em equilíbrio é dizer que a velocidade da reação direta é igual à velocidade da reação inversa.

Tá, mas e a matemática dessa parada toda? Vamos descomplicar isso também, utilizando o seguinte exemplo:
onde a, b e c são os coeficientes estequiométricos da reação; e A, B e C são elementares.
Aplicando a lei de velocidade, temos que:
v1 = k1.[A]a[B]b
Temos também a velocidade da reação inversa:
v2 = k2.[C]c
Mas sabemos que, no equilíbrio, pelo que fora visto aqui, v1 = v2.
Então teremos:
k1[A]a[B]b = k2[C]c
Assim, compreendemos que:
k1/ k2 = [C]c/[A]a[B]b
Chamamos essa razão k1/k2 de kc. Então, kc é a constante de equilíbrio em termos de concentração em mol/L.

Eu sou o homem mais inteligente da face da Terra… De novo!
Caaalma, não se desespere. Afinal, fazer essa pequena dedução é mais fácil do que tentar decorar tudo né? É possível generalizar, olha como fica simples:
kc = [Produtos]/[Reagentes].
NUNCA ESQUEÇA DOS COEFICIENTES ESTEQUIOMÉTRICOS!
A partir disso, é possível resolver qualquer exercício que envolve a constante de equilíbrio em termos de concentração!
Como nem tudo na vida são flores, há também outro tipo de constante que é deduzível da mesma forma: a constante de equilíbrio em termos das pressões parciais: kp.

Relaaaxa: não há mais complicações! A diferença é simples: enquanto kc é calculada a partir das concentrações no equilíbrio, kp é calculada a partir das pressões parciais dos gases da reação. Isso significa que kp é utilizada exclusivamente em reações no estado gasoso.
Resumindo: kp = Pprodutos/Preagentes

Sério?!?!
Tá, mas é possível relacionar kp e kc? A resposta para isso é SIM. A relação é deduzível, mas não convém ao ensino médio sabermos como deduzir. Quem seguirá a área de exatas e tiver disciplinas na universidade de físico-química saberá deduzir a relação entre kp e kc. Para nós, basta sabermos que kp = kc (R.T)Δn; onde a temperatura é em Kelvin, R é a constante universal dos gases e o Δn é a variação do número de mols dos gases da reação.

Please!
Já estamos acabando! Para resumir tudo, podemos pensar da seguinte forma: o vestibular sempre vai dar um dos dados – alguma constante – e pedir velocidade, ou pedir concentração de algum dos reagentes e produtos, ou até mesmo dar as concentrações e pedir uma das constantes, enfim.. Há diversas formas de se cobrar o equilíbrio químico. Não tente decorar uma forma de resolver, pois cada caso é um caso! Muito melhor entender a dedução, não acham?

Isso é tudo, pessoal!
É isso aí, galera! Que tal prova que entendeu tudo o que foi dito aqui resolvendo exercícios sobre Equilíbrio Químico?


