As Leis Ponderais na Química incluem a Lei de Proust e a Lei de Lavoisier. As duas são grandes contribuintes para o avanço da área, postuladas no século XVIII. Ambas também são essenciais para os estudos da estequiometria e de demais teorias que foram postuladas posteriormente. Fizemos um resumo com as informações essenciais acerca do assunto. Estude com ele e gabarite o vestibular!
Lei de conservação da massa
[caption id="attachment_64044" align="aligncenter" width="195"] Antoine Lavoisier[/caption]
Antoine Lavoisier[/caption]Não dá para falar sobre Leis Ponderais sem citar o contexto histórico delas. Por volta de 1774, o químico francês Antoine Laurent Lavoisier (1743-1794), sendo considerado o “pai” da Química Moderna, realizou inúmeras experiências com reações químicas. Elas eram sobre a combustão e a calcinação de substâncias envolvendo o uso de balanças de alta precisão para a época. Observou que dessas reações sempre resultavam óxidos cujo peso era maior que o das substâncias originalmente usadas.
Lavoisier realizou a calcinação do mercúrio metálico dentro de um recipiente fechado, no caso, uma retorta, que teve sua ponta introduzida em uma redoma contendo ar e colocada sobre uma cuba de vidro com mercúrio. No final da reação foi produzido óxido de mercúrio II, pois o mercúrio havia combinado com o oxigênio presente no ar para formar este produto. Notou-se que o nível do mercúrio da redoma havia subido, ocupando o espaço do ar. O volume inicial do ar foi reduzido ao fim do experimento.

No entanto, o recipiente fechado permaneceu com a mesma massa do início. Desse modo, o químico chegou à conclusão de que a massa ganha pelo metal foi compensada pela massa perdida pelo ar; o que significava que “algo” (o oxigênio, denominado assim pelo próprio Lavoisier) do ar havia “entrado” no metal ou se combinado com ele.
Pesando o sistema inicial (mercúrio metálico + oxigênio) e o sistema final (óxido de mercúrio II), Lavoisier percebeu que a massa total dos reagentes era igual à massa total dos produtos.
Ele repetiu esse experimento queimando outros materiais e percebeu que a massa dos sistemas permanecia constante em todos os casos.
Lei de Lavoiser a nível microscópico
Numa dada reação química, os átomos apenas se recombinam. Então, como não se destrói e nem se forma átomos, a massa de reagentes deve ser sempre igual à dos produtos.Atualmente, essa lei é mais conhecida pelo seguinte enunciado:
Exemplo:"Na Natureza, nada se cria, nada se perde, tudo se transforma"
Quando 2 gramas de hidrogênio reagem com 16 gramas de oxigênio, verifica-se a formação de 18 gramas de água;
H2(g) + ½ O2(g) → H2O(l)Do mesmo modo, quando 12 gramas de carbono reagem com 32 gramas de oxigênio, ocorre a formação de 44 gramas de gás carbônico.
C(s) + O2(g) → CO2(g)
Lei das Proporções de Massas ou Lei de Proust
[caption id="attachment_64048" align="aligncenter" width="235"] Químico Francês Joseph Louis Proust (1754-1826)[/caption]
Químico Francês Joseph Louis Proust (1754-1826)[/caption]A Lei das Proporções Constantes, famosa entre as Leis Ponderais, foi criada por Joseph Louis Proust (1754-1826) . Proust definiu a partir de diversos experimentos que duas substâncias se reúnem para formar um composto, sempre o fazem em uma mesma proporção, independentemente da quantidade de reagente presente no meio.
Decomposição de diferentes amostras de água:
Essa lei foi criada por Joseph Louis Proust (1754-1826) e pode ser enunciada assim:
“A proporção em massa das substâncias que reagem e que são produzidas numa reação é fixa, constante e invariável.”
Lei de Lavoiser a nível microscópico
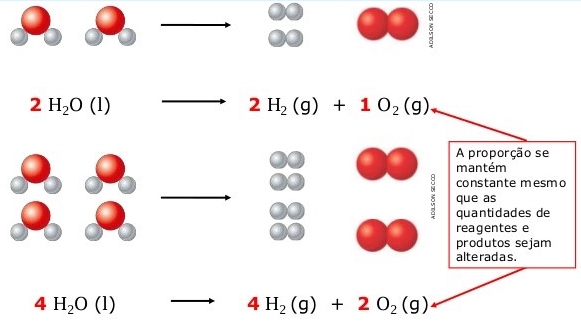
Você pode perceber que a proporção entre os átomos de oxigênio e hidrogênio nas moléculas de água é sempre 8:1, ou seja, a massa de oxigênio é 8 vezes maior que a massa de hidrogênio.
Analisando as substâncias em relação a sua classificação em substâncias puras e misturas, podemos perceber que a substância simples apresenta composição constante. Já as misturas não apresentam composição constante.
Consequências da Lei de Proust
A Lei de Proust, uma das principais Leis Ponderais, tem consequências, veja:- composição centesimal;
- cálculos estequiométricos.
Lei de Dalton

Formulada em 1803, pelo químico, físico e meteorologista inglês John Dalton, é também chamada Lei das Proporções Múltiplas. A Lei de Dalton diz que:
“Quando dois elementos químicos formam vários compostos, fixando-se a massa de um dos elementos, as massas do outro variam numa proporção de números inteiros e, em geral, pequenos.”Entre as Leis Ponderais, destacamos também a Lei de Dalton, que foi estabelecida em 1801 e relaciona as pressões parciais dos gases em misturas gasosas, dizendo que, em uma mistura gasosa, a pressão de cada componente independe da pressão dos demais e que a pressão total (P) é igual à soma das pressões parciais.
P1 + P2 = PT
Sendo P1 e P2 as pressões parciais dos componentes 1 e 2 e PT a pressão total exercida pela mistura de gases.Antes de prosseguir com a explicação, vamos definir o que é pressão e pressão parcial:
Pressão é a força exercida por um corpo sobre a área onde atua. Possui muitas unidades, mas uma largamente usada é o Pascal (Pa).Pascal = Pa = N / m2 = [Força] / [Área]
Pressão parcial é a pressão exercida por um dos componentes da mistura se estivesse sozinho e nas mesmas condições ocupando o mesmo espaço que a mistura gasosa ocupa.Como calcular a pressão parcial? Usando a lei dos gases ideais.
PV = n RT
Exemplo: Uma mistura de gás hélio e gás oxigênio
PTOTAL = PHe + PO2
É importante ressaltar que a pressão parcial de cada gás não é a pressão que ele exercia antes de entrar na mistura, quando estava isolado, mas corresponde à pressão que ele exerceria se estivesse sozinho, ocupando o volume total da mistura e na mesma temperatura em que a mistura se encontra, ou seja, é sua pressão dentro da mistura.Agora, vamos analisar uma mistura de nitrogênio e oxigênio presente no ar, 80% de gás nitrogênio e 20% de gás oxigênio. Digamos que, para cada 1 mol de ar, temos 0,8 mol de nitrogênio. Assim, a fração molar de cada um desses gases na mistura é dada pelas equações abaixo:
XN2 = nN2 XO2 = nO2Σn ΣnXN2 = 0,8 mol XO2 = 0,2 mol1,0 mol 1,0 molXN2 =0,8 XO2 = 0,2
Isso poderia ser dado também pelas pressões parciais, visto que a pressão total da mistura dentro do pneu é de 2,0 atm. Pela lei de Dalton, podemos concluir que a pressão parcial do gás nitrogênio nessa mistura é de 1,6 atm (80% de 2,0 atm) e a do gás oxigênio é de 0,4 atm (20% de 2,0 atm). Assim:
XN2 = PN2 XO2 = PO2PTOTAL PTOTALXN2 = 1,6 atm XO2 = 0,4 atm2,0 atm 2,0 atmXN2 =0,8 XO2 = 0,2
Observe que, visto que a fração molar é a relação entre um valor parcial e um valor total, a soma de todas as frações molares da mistura sempre será igual a 1:XN2 + NO2 = 1
Leis volumétricas de Gay-Lussac

Formuladas em 1808, pelo físico e químico francês Joseph Louis Gay-Lussac, serviram para a consolidação da Teoria Atômica Clássica, e afirmam que:
“Quando medidos nas mesmas condições de temperatura e pressão os volumes dos reagentes gasosos em uma reação química formam entre si uma proporção de números inteiros e pequenos.”“Quando medidos nas mesmas condições de temperatura e pressão, os volumes dos produtos gasosos em uma reação química formam com os reagentes gasosos uma proporção de números inteiros e pequenos.”

Observe a relação entre os volumes gasosos medidos nas mesmas condições de temperatura e pressão para os participantes da reação a seguir: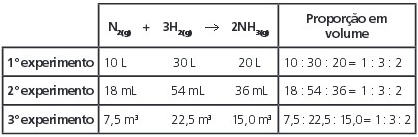
Os valores numéricos em cada proporção foram divididos pelo menor deles, resultando sempre na proporção de 1:3:2. Note que essa proporção coincide com os coeficientes da equação química balanceada. Teste seus conhecimentos sobre as Leis Ponderais com os exercícios abaixo.
Exercícios sobre as Leis Ponderais
1.(Fuvest-SP) Os pratos A e B de uma balança foram equilibrados com um pedaço de papel em cada prato e efetuou-se a combustão apenas do material contido no prato A. Esse procedimento foi repetido com palha de aço em lugar de papel. Após cada combustão, observou-se: Com papel Com palha de açoa) A e B no mesmo nível A e B no mesmo nívelb) A abaixo de B A abaixo de Bc) A acima de B A acima de Bd) A acima de B A abaixo de Be) A abaixo de B A e B no mesmo nível
Com papel Com palha de açoa) A e B no mesmo nível A e B no mesmo nívelb) A abaixo de B A abaixo de Bc) A acima de B A acima de Bd) A acima de B A abaixo de Be) A abaixo de B A e B no mesmo nível
VEJA COMO RESOLVER PASSO-A-PASSO ESTA QUESTÃO!2. (Mack-SP) Uma mistura de 1,5 mol de gás carbônico, 8 g de metano (16 g/mol) e 44,8 L de monóxido de carbono está contida em um balão de 30 L nas CNTP. É correto dizer que
Dado: volume molar nas CNTP = 22,4 L/mol.
a) a pressão parcial do monóxido de carbono é o dobro da do metano.b) a pressão parcial do metano é o triplo da do gás carbônico.c) a pressão do gás carbônico é 1/4 da do monóxido de carbono.d) a pressão parcial do monóxido de carbono é o quádruplo da do metano.e) a pressão total é igual a 4 atm.
VEJA COMO RESOLVER PASSO-A-PASSO ESTA QUESTÃO!3. Observe na tabela a seguir as massas dos reagentes e do produto de uma reação que foram obtidas em várias experiências:
[caption id="attachment_64059" align="aligncenter" width="300"] Tabela com dados em exercício sobre a lei das proporções constantes de Proust[/caption]
Tabela com dados em exercício sobre a lei das proporções constantes de Proust[/caption]
Baseado na lei das proporções constantes de Proust, determine os valores de A, B, C, D, E e F, respectivamente:a) 56g, 68g, 3g, 17g, 6g, 11gb) 34g, 46g, 20g, 34g, 28g, 5gc) 56g, 34g, 6g, 34g, 28g, 11gd)34g, 68g, 3g, 34g, 6g, 11ge) 46g, 58g, 3g, 17g, 6g, 11g
VEJA COMO RESOLVER PASSO-A-PASSO ESTA QUESTÃO!
Gabarito
1. D2. D3. AAgora que você já sabe tudo sobre as Leis Ponderais, veja as nossas questões comentadas sobre o assunto!


