Eletroquímica – Pilha
A eletroquímica é o ramo da química que trabalha com o uso de reações químicas espontâneas para produzir eletricidade, e com o uso da eletricidade para forçar a ocorrência as reações químicas não-espontâneas.
Equações de oxi-redução
As reações estudadas aqui são particularmente reações de oxi-redução. A chave para escrever e balancear equações de reações redox é considerar os processos de redução e oxidação separadamente. Demonstramos então as semirreações de ambos os processos.
Exemplos:Mg(s) → Mg2+ (s) + 2e-Fe3+ (aq) + e- → Fe2+ (aq)
Pilha
Íons Cu2+(aq) solução migram até a placa de cobre e recebem os elétrons cedidos pelo Zn(s). Ao receberem os elétrons, se transformam em Cu(s), de acordo com a equação:

Ao ceder elétrons através do condutor metálico para o íon Cu2+(aq), devido à ddp entre os dois eletrodos, Zn(s) da placa vai para a solução na forma de Zn2+(aq), causando assim a corrosão da placa e consequente aumento da concentração de Zn2+(aq) na solução, de acordo com a equação:
Assim, devido à diferença de potencial criada entre os dois eletrodos, observamos que existe um movimento ordenado de cargas no fio condutor, ou seja, uma corrente elétrica. Podemos observar de fato ao conseguirmos acender uma lâmpada com o acionamento da pilha.
Portanto, pilhas são sistemas que possuem capacidade de produzir energia elétrica a partir de uma reação química. Estes sistemas podem ser chamados também de células galvânicas e esta transforma a energia de uma reação química em energia elétrica.
Ponte Salina
Para evitar que ocorra a mistura das soluções, utiliza-se a ponte salina, que une os dois compartimentos do eletrodo e completa o circuito elétrico. A ponte salina é formada por um gel contendo solução salina aquosa concentrada dentro de um tubo. A solução salina mais utilizada é o KCl, pois os íons K+ e Cl– não afetam as reações que ocorrem nas células.Conforme a lâmina de zinco corrói, a solução do eletrodo de zinco vai ganhando cátions Zn2+(aq) (cargas positivas).Haverá no eletrodo um excesso de cargas positivas.
Conforme a lâmina de cobre aumenta a sua massa , a solução do eletrodo de cobre vai perdendo cátions Cu2+(aq) (cargas positivas). Haverá no eletrodo excesso de cargas negativas SO42-(aq).
A função da ponte salina é manter o equilíbrio elétrico de cargas positivas e negativas nas soluções dos eletrodos. Assim, K+ migra da ponte para o eletrodo de cobre e Cl– migra para o eletrodo de zinco.
No condutor existe uma corrente de elétrons; já na ponte salina existe uma corrente de íons.
Reação Global da Pilha
Nomenclatura dos Eletrodos
Condições para Condução da Corrente Elétrica
Precisa-se de uma diferença de potencial (ddp) e um meio condutor para que possamos conduzir corrente elétrica.Como o eletrodo de cobre (Cu2+/Cu) possui maior potencial de redução que o eletrodo de zinco (Zn2+/Zn), podemos dizer que entre os eletrodos existe uma ddp. Se entre esses eletrodos intercalarmos um fio condutor, agora teremos condições para condução da corrente elétrica.
Potencial de eletrodo
Um eletrodo (que em grego significa "caminho para a eletricidade") é formado por um metal, mergulhado numa solução contendo cátions desse metal.
O potencial de oxidação (Eoxi) de um eletrodo indica sua tendência a sofrer oxidação, ou seja, a liberar elétrons. Já o potencial de redução (Ered), indica a tendência do eletrodo a ganhar elétrons sofrendo redução.
Devido à influência da temperatura e da concentração no potencial de eletrodo, convencionou-se que sua medida fosse realizada a 25°C, em solução 1mol/L e à pressão de 1atm. Desse modo, tem-se o potencial padrão do eletrodo (E°).
Um voltímetro é um aparelho que fornece as diferenças de potencial elétrico entre os pólos de uma pilha (∆E). Para determinar os Eoxi e Ered das diversas espécies, foi escolhido como padrão o eletrodo de hidrogênio, ao qual foi atribuído o potencial de 0 volt. Confrontando todos os metais com o eletrodo padrão de hidrogênio, obtiveram-se seus E° organizando-os numa tabela.
Diferença de potencial da pilha
O potencial de redução e de oxidação são medidos em volt (V) e são representados pelo símbolo E°.
∆E° = E°OX + E°RED∆E° = E°CATODO - E°ANODO∆E° = E°MAIOR - E°MENOROnde:∆E° = variação de potencialE° = diferença de potencial (padrão)E°RED = potencial de reduçãoE°OX = potencial de oxidação
Padrão: 25°C e 1atm
Pode-se utilizar qualquer uma destas fórmulas, dependendo dos dados que são fornecidos.A diferença de potencial pode ser chamada também de força eletromotriz (fem).
Quanto maior o E°RED mais o metal se reduz.Quanto maior o E°OX mais o metal se oxida.
Exemplo:
No caso da pilha de Daniell, o potencial de redução do zinco é – 0,76 e o potencial de redução do cobre é + 0,34. Assim, o valor da ddp dessa pilha será:
Zn2+(aq) + 2 e- ↔ Zn( s) Ered = - 0,76 V
Cu2+(aq) + 2 e- ↔ Cu( s) Ered = + 0,34 V
∆E0 = E0red (maior) - E0red (menor)∆E0 = Ered Cu2+ - Ered Zn2+∆E0 = + 0,34 – (- 0,76)∆E0 = + 1,10 V
Espontaneidade das Reações de Oxirredução
Quanto maior o potencial de redução de um elemento, maior a tendência em ganhar elétrons. Portanto, ele recebe elétrons de um outro elemento de menor potencial de redução. Para o potencial de oxidação, quanto maior o valor de E0, maior a tendência em perder elétrons e, portanto, ceder elétrons para outro elemento de menor potencial de oxidação.Por exemplo:
Zn0(s) + Cu2+(aq) → Zn2+(aq) + Cu0(s)
Dados:
Cu2+ + 2 e– → Cu° E = + 0,34 VZn2+ + 2 e– → Zn° E = – 0,76 V
Para sabermos se a reação é espontânea ou não, devemos adotar a seguinte conduta:
– verificar, no sentido indicado da reação, a espécie que sofre oxidação (perde e–) e a espécie que sofre redução (ganha e–);
– se a espécie que sofre redução apresentar um maior que o da espécie que sofre oxidação, a reação é espontânea; caso contrário, não.
O fato de o íon Cu2+ apresentar um Ered maior significa que ele possui capacidade de atrair e– do Zn(s), e, sendo assim, a reação será espontânea.
A reação de óxido-redução pode ser espontânea ounão-espontânea:
Aplicação da Pilha - Proteção
Objetos metálicos podem ser protegidos da corrosão de vários modos diferentes:– aplicação de uma camada de tinta na superfície metálica;
– cobrir a superfície metálica com outro metal (eletrólise);
– colocar o metal a ser protegido em contato com outro metal que apresente um potencial de oxidação maior. Neste caso, o metal de maior potencial de oxidação sofre corrosão (oxidação), protegendo o metal de menor potencial de oxidação. Por exemplo, Mg e Zn são utilizados para a proteção do Fe contra a ferrugem. Mg e Zn são denominados metaisdesacríficio.
Exercícios
1. As pilhas e as baterias são dispositivos nos quais uma reação espontânea de oxidorredução transforma energia química em energia elétrica. Portanto, sempre há uma substância que se reduz, ganhando elétrons, que é o cátodo, e uma que se oxida, perdendo elétrons, que é o ânodo. Abaixo, temos um exemplo de uma pilha eletroquímica: A respeito dessa pilha, responda:a) Qual eletrodo, A ou B, está sofrendo redução e qual está sofrendo oxidação?b) Qual eletrodo é o cátodo e qual é o ânodo?c) Escreva a semirreação que ocorre nos eletrodos A e B e a reação global da pilha.d) concentração dos íons B3+e A2+aumenta ou diminui?e) Ocorre corrosão ou deposição dos eletrodos A e B?
A respeito dessa pilha, responda:a) Qual eletrodo, A ou B, está sofrendo redução e qual está sofrendo oxidação?b) Qual eletrodo é o cátodo e qual é o ânodo?c) Escreva a semirreação que ocorre nos eletrodos A e B e a reação global da pilha.d) concentração dos íons B3+e A2+aumenta ou diminui?e) Ocorre corrosão ou deposição dos eletrodos A e B?2. (UERJ – 2010) A célula a combustível é um tipo de pilha que gera energia elétrica a partir da reação química entre os gases hidrogênio e oxigênio, como mostra o esquema:
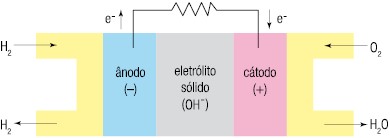
Para seu funcionamento ininterrupto, a célula precisa ser continuamente alimentada com o oxigênio do ar e com o gás hidrogênio proveniente da seguinte reação química:Considere os valores abaixo, relativos ao funcionamento da célula sob condições-padrão:![]()
Considere os valores abaixo, relativos ao funcionamento da célula sob condições-padrão:
Calcule a força eletromotriz, em volts, da célula a combustível e a variação de entalpia, em kJ, da reação de obtenção do hidrogênio.
3. (UFPE) Considere uma cela galvânica formada por semicelas-padrão de cobre e de zinco, cujos potenciais de redução são os seguintes:Cu2+ + 2 e- → Cu Eº = + 0,34 VZn2+ + 2 e- → Zn Eº = - 0,76 V
É correto afirmar que:a) os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.b) o potencial-padrão da cela é – 0,42 V.c) quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.d) os íons zinco são reduzidos a zinco metálico.e) o eletrodo de cobre é o cátodo.
GABARITO
2. E° = 1,23 V; 163 kJ3. E





