Você sabe o que é equilíbrio químico? Ainda tem dúvidas sobre o assunto? Hoje você vai aprender tudo que precisar saber sobre isso para arrasar na sua prova de química!
ORGANIZE ESSA MATÉRIA EM UM RESUMO LINDÃO! <3
Entenda o que é equilíbrio químico
O equilíbrio químico ocorre quando, em uma reação reversível, a velocidade da reação direta é igual à velocidade da reação inversa. Uma vez atingido o estado de equilíbrio, as concentrações de reagentes e produtos permanecem constantes. Consideremos a equação genérica:onde v1 é a velocidade da reação direta e v2 a velocidade da reação inversa.
Esse estado é alcançado, em outras palavras, quando a concentração de reagentes e produtos permanece constante. Observe:
No início, v1 é o máximo porque as concentrações de A e B apresentam valores máximos, enquanto v2 é igual a zero, porque C e D ainda não foram formados. À medida que a reação ocorre, A e B diminuem, e C e D aumentam, portanto, v1 diminui e v2 aumenta, até que as duas velocidades se igualem. No instante em que v1 = v2, podemos dizer que o sistema atinge o estado de equilíbrio.
Atingido o estado de equilíbrio, a reação química continua a ocorrer (nível microscópico) nos dois sentidos, com a mesma velocidade e, portanto, as concentrações de reagentes e produtos ficam constantes. Por isso, podemos dizer que o equilíbrio é um equilíbrio dinâmico.
Ao considerarmos o sistema como um todo (nível macroscópico), aparentemente a reação “parou” de acontecer, porque as concentrações de reagentes e produtos permanecem inalterados indefinidamente.
Para que o estado de equilíbrio possa ser atingido, é necessário que:
- o sistema encontre-se num recipiente fechado;
- a temperatura fique constante.
Classificação
Os equilíbrios químicos podem ser classificados em homogêneos e heterogêneos.Equilíbrio Homogêneo
É aquele em que todos os participantes se encontram em uma única fase. Portanto, classificamos o sistema como sendo homogêneo.Equilíbrio Heterogêneo
É aquele em que os participantes se encontram em mais de uma fase. Portanto, classificamos o sistema como sendo heterogêneo.Constante de equilíbrio químico
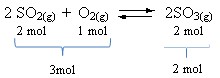
As constantes de equilíbrio são determinadas com base nas concentrações, em mol/L, das espécies químicas envolvidas e são representadas por KC. Observe o exemplo a seguir:
2 Fe(s) + 3 Cu2+(aq)Podemos utilizar a seguinte fórmula para calcularmos o Kc:
Assim: KC = [Fe3+] 2[Cu2+] 3
Observações:
a) A constante de equilíbrio Kc varia com a temperatura;b) Quanto maior o valor de Kc, maior o rendimento da reação, já que no numerador temos os produtos e no denominador os reagentes. Portanto, comparando valores de Kc em duas temperaturas diferentes, podemos saber em qual destas a reação direta apresenta maior rendimento;
c) O valor numérico de Kcdepende de como é escrita a equação química.
Por este motivo devemos escrever sempre a equação química junto com o valor de Kc.
d) A constante de equilíbrio é adimensional, ou seja, não possui unidade.
Constante de Equilíbrio em Termos das Pressões Parciais (Kp)
Quando os componentes do equilíbrio são substâncias gasosas, além da constante Kc, podemos expressar a constante de equilíbrio em termos de pressões parciais (Kp).Assim para a reação:
a constante de equilíbrio pode ser expressa na seguinte fórmula:Portanto, concluímos que Kp é a razão entre o produto das pressões parciais dos produtos gasosos e o produto das pressões parciais dos reagentes gasosos, estando todas as pressões elevadas a expoentes iguais aos respectivos coeficientes, na equação química balanceada.
Por exemplo:
Observação: Para equilíbrio em sistema heterogêneo, o estado sólido não participa das expressões Kp e Kc, o estado líquido participa somente de Kc, e o estado gasoso participa das duas expressões.
A relação entre as constantes, KC e Kp pode ser expressa genericamente por:![]()
Onde:
n → variação da quantidade em mols (diferença entre a quantidade em mols dos produtos e reagentes).
Kc → constante de equilíbrio em termos de concentração molar.
KP → constante de equilíbrio em termos das pressões parciais.
T → temperatura absoluta.
R → constante dos gases.
Grau de equilíbrio (α)
O grau de equilíbrio é a relação entre a quantidade de matéria (em mol) que reagiu e a quantidade de matéria inicial no sistema para cada espécie. Considere o exemplo a seguir:Exemplo:
Consideramos a reação x → y + z, em que, no início, encontramos 2,00 mols de x e no equilíbrio são encontrados 0,80 mols de x sem reagir. Concluímos, então, que reagiu 2,00 – 0,80 = 1,20 mols de x. O grau de equilíbrio fica:![]()
Concluindo, podemos dizer que, quanto maior o valor de α no equilíbrio, encontramos menor sobra de reagentes em maior quantidade de produtos. Quanto menor o valor de α no equilíbrio, encontramos muita sobra de reagentes e pouco produto.
Espontaneidade de uma reação e o valor de Kc

Princípio de Le Chatelier
“Quando uma força externa age sobre um sistema em equilíbrio, este se desloca, procurando anular a ação da força aplicada.”Um equilíbrio pode ser alterado por modificações nas concentrações das substâncias, na pressão ou na temperatura
a) pressão sobre o sistema;
b) temperatura;
c) concentração dos reagentes ou produtos.
Fatores que alteram o estado de equilíbrio
Efeito da pressão
Uma modificação na pressão em um sistema só altera o equilíbrio quando há variação do(s) coeficiente(s) estequiométrico(s) dos gases nos produtos em relação aos reagentes.De maneira geral:Aumento da pressão favorece o sentido com menor quantidade em mol de gás (menor volume)
Diminuição da pressão favorece o sentido com maior quantidade em mol de gás (maior volume)
Exemplo:
Efeito da temperatura
O aumento de temperatura de um sistema em equilíbrio favorece mais o sentido da reação endotérmica. A diminuição de temperatura de um sistema em equilíbrio, no entanto, favorece o sentido da reação exotérmica. Lembre-se de que ΔH >0 indica que o processo é endotérmico, já ΔH < 0, que o processo é exotérmico.
Exemplo:Considerando a reação hipotética, sob pressão e concentração constantes:A(g)⟺ B(g), ΔH > 0 (reação endotérmica)➢ Se aumentarmos a temperatura, o equilíbrio se desloca para direita e o rendimento aumenta.➢ Se diminuirmos a temperatura, o equilíbrio se desloca para esquerda.Agora, seja a reação hipotética, sob pressão e concentração constantes:B(g)⟺ A(g), ΔH < 0 (reação exotérmica)➢ Se aumentarmos a temperatura, o equilíbrio se desloca para esquerda e o rendimento diminui.➢ Se diminuirmos a temperatura, o equilíbrio se desloca para a direita e o rendimento aumenta.
Efeito da concentração
A adição de uma substância (reagente ou produto) em um equilíbrio, de modo geral, favorece o sentido de consumo dessa substância. Analogamente, a remoção de uma substância em um equilíbrio, de modo geral, favorece o sentido da formação dessa substância.Efeito do catalisador
Os catalisadores aceleram igualmente as reações direta e inversa, de forma que nenhum dos sentidos do equilíbrio é favorecido. A presença de um catalisador fará com que o sistema atinja o equilíbrio mais rapidamente.Agora que você já sabe o que é equilíbrio químico, faça os exercícios abaixo para treinar o conhecimento que acabou de adquirir!
Exercícios sobre o que é equilíbrio químico
Pratique tudo que aprendeu sobre o que é equilíbrio químico nos três exercícios abaixo.1. (UFPB) No mundo atual, são produzidas milhões de toneladas de compostos nitrogenados, entre os quais os fertilizantes são os mais importantes pelo papel que desempenham na produção de alimentos. Esses adubos agrícolas nitrogenados são fabricados a partir da amônia, que é produzida industrialmente através da síntese de Haber-Bosch, descrita pela seguinte equação:
N2(g) + 3 H2(g) ![]() NH3(g) ∆H = -113 kJ/mol
NH3(g) ∆H = -113 kJ/mol
Considerando a equação e a condição de equilíbrio do sistema, é correto afirmar que o rendimento da produção de amônia:a) diminui com a remoção de NH3.b) aumenta com a elevação da temperatura.c) aumenta com o aumento da concentração de H2.d) permanece inalterado com a diminuição da concentração de N2.e) permanece inalterado com a redução do volume do reator
2. (Fuvest-SP) A reforma do gás natural com vapor de água é um processo industrial de produção de hidrogênio, em que também se gera monóxido de carbono. O hidrogênio, por sua vez, pode ser usado na síntese de amônia, na qual reage com nitrogênio. Tanto a reforma do gás natural quanto a síntese da amônia são reações de equilíbrio. Na figura, são dados os valores das constantes desses equilíbrios em função dos valores da temperatura. A curva de K1 refere-se à reforma do gás natural e a de K2, à síntese da amônia. As constantes de equilíbrio estão expressas em termos de pressões parciais, em atm.
a) Escreva a equação química balanceada que representa a reforma do principal componente do gás natural com vapor de água.b) Considere um experimento a 450 °C, em que as pressões parciais de hidrogênio, monóxido de carbono, metano e água são, respectivamente, 0,30; 0,40; 1,00 e 9,00 atm. Nessas condições, o sistema está em equilíbrio químico? Justifique sua resposta por meio de cálculos e análise da figura.c) A figura permite concluir que uma das reações é exotérmica e a outra, endotérmica. Qual é a reação exotérmica? Justifique sua resposta
3. (Fatec-SP) O gráfico ao lado mostra como varia a constante de equilíbrio (KC) em função da temperatura para a reação de síntese da amônia.
A respeito dessa transformação química, as seguintes afirmações foram feitas:
I.A diminuição da temperatura aumenta o rendimento da reação.II.A elevação da temperatura diminui a velocidade da reação.III.A reação de síntese da amônia é exotérmica.IV.A elevação da temperatura favorece o consumo de N2 e H2. Dessas afirmações, são corretas apenas:
a) I e II.b) I e III.c) III e IV.d) II e III.e) II e IV
Gabarito
1. C2. a) O principal componente do gás natural é o metano, portanto, a equação química que representa a reforma do principal componente do gás natural com vapor de água é:CH4(g) + H2O(g)b) Pela análise do gráfico, a constante de equilíbrio a 450 °C é K1 = 1,2 . 10-3 atm2 . Com os dados fornecidos, pode-se calcular o quociente de equilíbrio:Qc = [produtos] = (p H2 )3. p CO = 0,33 . 0,4 = 1,2 . 103 atm2[reagentes] p CH4 . p H2O 1 . 9
Como Qc = K1 , o sistema está em equilíbrio químico.
c) Pelo Princípio de Le Châtelier, a reação exotérmica é favorecida pela diminuição da temperatura. A análise do gráfico mostra que a constante cujo valor aumenta com a diminuição da temperatura é K2, que se refere à síntese da amônia.
3. B