Você sabe quais são as principais unidades de concentração química? Sabe que elas caem no vestibular? Aprenda com a gente a desvendar essa matéria!

Concentração comum de uma solução (C)
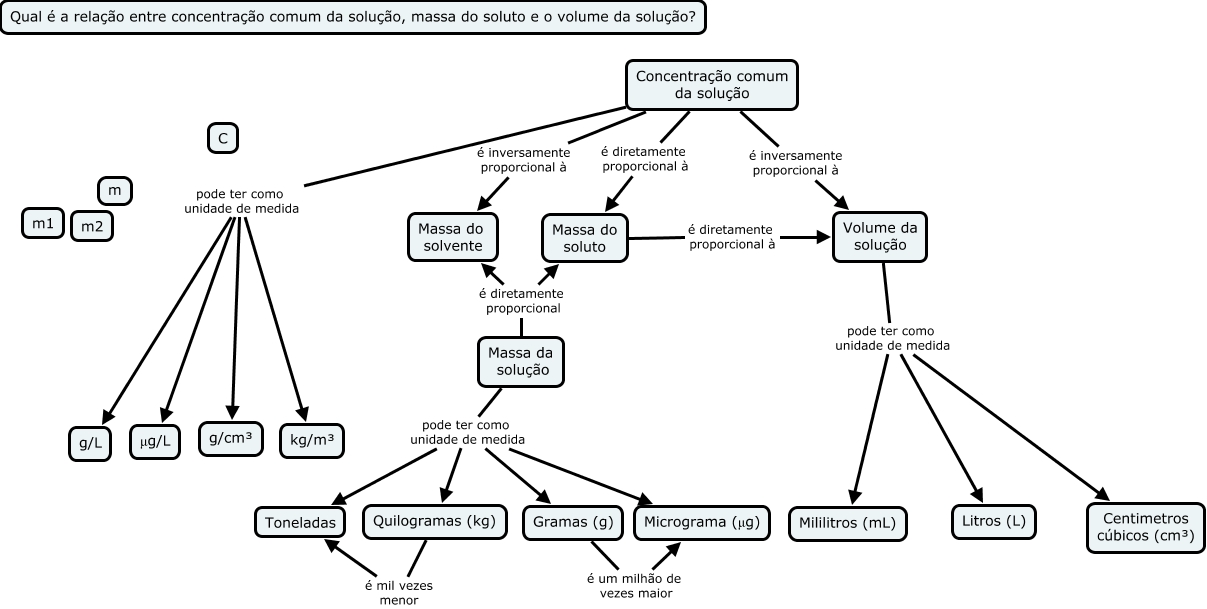
A chamada concentração comum de uma solução é dada pela razão entre a massa do soluto, m, em gramas (g) e o volume, v, da solução em litros (L). A unidade usual é g/L, a do Sistema Internacional (SI) é kg/m³:C = m / v
Pode ainda ser expressa pelas unidades físicas g/ml, g/cm³, kg/L. Podemos usar ainda variações como g/100ml, g/100 cm³ ou g/dL ou ainda mg/mL.Molaridade ou concentração molar
[caption id="attachment_65793" align="aligncenter" width="329"] Soluções de Nitrato de Prata 0,1M e Sulfato de Cobre 0,1M[/caption]
Soluções de Nitrato de Prata 0,1M e Sulfato de Cobre 0,1M[/caption]Molaridade ou concentração molar ou concentração em mol/L ou concentração em quantidade de matéria é a razão da quantidade de matéria do soluto (mol) pelo volume de solução (em litros), expressa na unidade mol/L (molar).
M = n/V
M é a molaridade, n é a quantidade de matéria (antigamente dita "número de mol") e V é o volume da solução. A unidade comum está dada em mol/L.Quantidade de matéria ou número de mols (n) é a relação entre a massa do soluto (m) (em gramas) e a massa molar (MM) da substância (em g/mol):
n = m/MM
Juntando as duas equações, temos a forma expandida:M = m/ MM. V
Fração em mols ou fração molar
Fração Molar do Soluto (x1): é a razão estabelecida entre o número de mols de moléculas do soluto (n1) e o número de mols de moléculas da solução (n).Fração Molar do Solvente (x2): é a razão estabelecida entre o número de mols de moléculas do solvente (n2) e o número de mols de moléculas da solução (n).
Obs.: x1 + x2 = 1Obs.: A Fração molar não possui unidade
Densidade
[caption id="attachment_65796" align="aligncenter" width="300"] Esta figura mostra a diferença de densidade entre o álcool, o óleo e a água + tinta[/caption]
Esta figura mostra a diferença de densidade entre o álcool, o óleo e a água + tinta[/caption]A densidade de um corpo poderá ser determinada pela quantidade de massa que o corpo possui dividido pelo volume que esta massa ocupa. A densidade pode ser determinada pela expressão matemática:![]() Exemplo: Uma caixa com algodão cuja massa é de 200g, ocupa o volume de 2000 cm³.
Exemplo: Uma caixa com algodão cuja massa é de 200g, ocupa o volume de 2000 cm³.
Soluções percentuais ou Títulos:
Porcentagem em massa (m/m) ou título em massa (T%)
É a massa de soluto, em gramas, presente em 100 g de solução.Quando dizemos que uma solução se encontra a 10 % em massa, estamos dizendo que em 100g de solução há 10 g de soluto.
O percentual em massa pode ainda ser determinado pela fórmula:
% m/m = _m soluto_ x 100m solução
Percentual em massa por volume (%)
É a massa de soluto, em gramas, presente em 100 mL de solução.Quando dizemos que uma solução se encontra a 10 % , estamos dizendo que em 100 mL de solução há 10 g de soluto
% m/V = _m soluto x 100V solução
Percentual em volume ou título em volume (%V/V)
É o volume de soluto, em mL, presente em 100 mL de solução.Quando dizemos que uma solução se encontra a 10 % V/V, estamos dizendo que em 100 mL de solução há 10 mL de soluto.
% V/V = _V soluto_ x 100V soluçãoObs1.: 1cm3 = 1mL; 1dm3 = 1L; 1000L = 1m3;
Obs2.: O título em volume não possui unidade.
Existem alguns casos em que a massa do soluto presente na solução é tão pequena, que praticamente a massa do solvente é igual à massa da solução. Nesses casos, não se pode usar como referencial uma porcentagem, ou seja, analisar quantos gramas de soluto há em 100 unidades da solução. Assim, é preciso usar como referencial partes maiores da solução, como 1000 000 ou 106, isto é, partes por milhão (ppm).
“ A concentração em ppm indica a quantidade, em gramas, de soluto presente em 1000000 (106) gramas de solução.”O cálculo matemático em ppm é feito com a seguinte fórmula:
1 ppm = 1 parte de soluto_106 partes de solução |
Existem casos em que a solução está tão diluída que é necessário usar partes por bilhão (ppb) ou até partes por trilhão (ppt). Suas fórmulas são, respectivamente:
1 ppb = 1 parte de soluto_109 partes de solução |
1 ppt = 1 parte de soluto_1012 partes de solução |
 Esquema sobre as concentrações e as unidades mais utilizadas[/caption]
Esquema sobre as concentrações e as unidades mais utilizadas[/caption]Se a solução for sólida ou líquida, a concentração em ppm é dada em massa; já se for no estado gasoso, ela será fornecida em volume.
Exercícios
1. (UFSCar-2002) O flúor tem um papel importante na prevenção e controle da cárie dentária. Estudos demonstram que, após a fluoretação da água, os índices de cáries nas populações têm diminuído. O flúor também é adicionado a produtos e materiais odontológicos. Suponha que o teor de flúor em determinada água de consumo seja 0,9 ppm (partes por milhão) em massa. Considerando a densidade da água 1 g/mL, a quantidade, em miligramas, de flúor que um adulto ingere ao tomar 2 litros dessa água, durante um dia, é igual a
a) 0,09b) 0,18c) 0,90d) 1,80e) 18,0
VEJA COMO RESOLVER PASSO-A-PASSO ESTA QUESTÃO!
2. (UFMG-2003) A presença do oxigênio dissolvido é de fundamental importância para a manutenção da vida em sistemas aquáticos. Uma das fontes de oxigênio em águas naturais é a dissolução do oxigênio proveniente do ar atmosférico. Esse processo de dissolução leva a uma concentração máxima de oxigênio na água igual a 8,7mg/L, a 25 ºC e 1atm. Um dos fatores que reduz a concentração de oxigênio na água é a degradação de matéria orgânica. Essa redução pode ter sérias consequências - como a mortandade de peixes, que só sobrevivem quando a concentração de oxigênio dissolvido for de, no mínimo, 5mg/L.
a) Calcule a massa de oxigênio dissolvido em um aquário que contém 52 litros de água saturada com oxigênio atmosférico, a 25º C e 1 atm.b) Calcule a massa de oxigênio que pode ser consumida no aquário descrito, no item 1 desta questão, para que se tenha uma concentração de 5 mg/L de oxigênio dissolvido.c) A glicose (C6H12O6), ao se decompor em meio aquoso, consome o oxigênio segundo a equação:C6H12O6 (aq) + 6O2 (aq) → 6CO2 (aq) + 6H2O(l) Calcule a maior massa de glicose que pode ser adicionada ao mesmo aquário, para que, após completa decomposição da glicose, nele permaneça o mínimo de 5mg/L de oxigênio dissolvido.
VEJA COMO RESOLVER PASSO-A-PASSO ESTA QUESTÃO!
3. (UFSCar-2000) Soro fisiológico contém 0,900 gramas de NaCl, massa molar = 58,5 g/mol, em 100 mL de solução aquosa. A concentração do soro fisiológico, expressa em mol/L, é igual a:
a) 0,009b) 0,015c) 0,100d) 0,154e) 0,900
VEJA COMO RESOLVER PASSO-A-PASSO ESTA QUESTÃO!
4. (UFMG-1997) O rótulo de um produto usado como desinfetante apresenta, entre outras, a seguinte informação. Cada 100 mL de desinfetante contém 10 mL de solução de formaldeído 37% V/V (volume de formaldeído por volume de solução). A concentração de formaldeído no desinfetante, em porcentagem volume por volume, é
a) 1,0%b) 3,7%c) 10%d) 37%
VEJA COMO RESOLVER PASSO-A-PASSO ESTA QUESTÃO!
5. (PUC - RS-2006) O Ministério da Saúde recomenda, para prevenir as cáries dentárias, 1,5 ppm (mg/L) como limite máximo de fluoreto em água potável. Em estações de tratamento de água de pequeno porte, o fluoreto é adicionado sob forma do sal flúor silicato de sódio (Na2SiF6; MM = 188g/mol). Se um químico necessita fazer o tratamento de 10000 L de água, a quantidade do sal, em gramas, que ele deverá adicionar para obter a concentração de fluoreto indicada pela legislação será, aproximadamente, de
a) 15,0b) 24,7c) 90,0d) 148,4e) 1500,0
VEJA COMO RESOLVER PASSO-A-PASSO ESTA QUESTÃO!
Gabarito
1. D
2. 452mg de O2; 192 mg de O2; 0,18 g de C6H12O6
3. D
4. B
5. B
