
Se você olhar lá no dicionário a palavra mistura, irá encontrar o seguinte:
Substantivo feminino1. ato ou efeito de misturar(-se).2. composto ou produto resultante de coisas misturadas; mescla, misto, amálgama.Ou seja, partimos do princípio de que, para ocorrer uma mistura, precisamos de 2 ou mais “coisas”. Na Química, definimos essas coisas como substâncias. Então, vamos definir a mistura assim:
A Mistura é formada por duas ou mais substâncias puras. As misturas têm composição química variável, não expressa por uma fórmula.
Ora, agora temos outra incógnita: O que é uma substância pura? Para responder, vamos classificar as substâncias!Classificação das Substâncias
Substância pura é aquela formada exclusivamente por partículas (moléculas ou átomos) quimicamente iguais.As substâncias puras podem ser simples ou compostas.
O gás nitrogênio (N2) é uma substância pura simples, pois é formado apenas pelo elemento N. Já a água é uma substância pura composta, pois contém dois elementos em suas moléculas (H2 + O).
Agora sim, vamos trabalhar com as misturas!
Misturas são formadas por duas ou mais substâncias e se classificam em homogênea ou heterogênea, dependendo da natureza de seus constituintes, uma vez que toda mistura homogênea é uma solução.- O ar que respiramos é uma mistura homogênea de vários componentes, entre eles nitrogênio e oxigênio.- A água do mar é uma mistura homogênea de sais minerais + H2O.- O petróleo é uma mistura homogênea que pode ser fracionada (processo conhecido por destilação) e dar origem a vários produtos: gasolina, querosene, parafina, óleo, etc.
Define-se assim :
Mistura Homogênea – é formada por apenas uma fase. Não se consegue diferenciar a substância.[caption id="attachment_65151" align="aligncenter" width="300"] Mistura homogênea[/caption]
Mistura homogênea[/caption]
[caption id="attachment_65150" align="aligncenter" width="270"] Mistura heterogênea - água e óleo[/caption]
Mistura heterogênea - água e óleo[/caption]
Sendo FASE o aspecto visual uniforme.
[caption id="attachment_65144" align="aligncenter" width="515"] A mistura de sulfato de cobre com água e com etanol forma, respectivamente, mistura homogênea e mistura heterogênea[/caption]
A mistura de sulfato de cobre com água e com etanol forma, respectivamente, mistura homogênea e mistura heterogênea[/caption]
Os sistemas monofásicos são as misturas homogêneas e os sistemas polifásicos são as misturas heterogêneas.Os sistemas homogêneos, quando formados por duas ou mais substâncias miscíveis (que se misturam) umas nas outras, são chamados de soluções. São exemplos de soluções: água salgada, vinagre, álcool hidratado.
Os sistemas heterogêneos podem ser formados por uma única substância, porém em várias fases de agregação (estados físicos).
Exemplo: água- líquida- sólida (gelo)- vapor
Identificando misturas homogêneas e heterogêneas através do gráfico de aquecimento
Curva de aquecimento é o gráfico que mostra a variação de temperatura de uma amostra quando aquecida ou resfriada, incluindo-se as mudanças de estado físico.
Sabemos que durante uma mudança de estado físico a temperatura permanece constante (Q=mL) e que, durante o aquecimento sem mudança de estado, sua variação é linear . Assim, a curva acima é característica, mostrando dois patamares, um no ponto de fusão (PF) e outro no ponto de ebulição (PE).
Levantando experimentalmente a curva de aquecimento de uma amostra, quatro coisas podem acontecer:
- A curva apresenta temperatura constante no ponto de fusão e de ebulição;
- A curva apresenta variação de temperatura no ponto de fusão e de ebulição;
- A curva apresenta variação de temperatura apenas no ponto de fusão e no de ebulição permanece constante;
- A curva apresenta temperatura constante no ponto de fusão e variação de temperatura no de ebulição.
[caption id="attachment_65148" align="aligncenter" width="250"]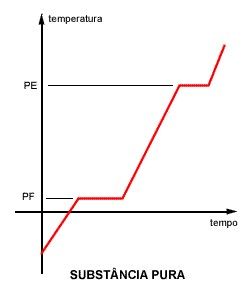 Gráfico (Txt) de uma substância pura[/caption]
Gráfico (Txt) de uma substância pura[/caption]
[caption id="attachment_65145" align="aligncenter" width="300"] Mistura comum[/caption]
Mistura comum[/caption]
Quando a curva apresenta variação nos dois pontos (PF e PE), dizemos que é uma mistura comum. Quando um, e apenas um dos pontos apresenta variação, essa mistura receberá um nome especial:
PF varia e PE constante: mistura azeotrópicaPF constante e PE varia: mistura eutéticaExemplos comuns dessas misturas são: água e álcool para mistura azeotrópica e gelo e sal de cozinha para mistura eutética.
[caption id="attachment_65143" align="aligncenter" width="300"]
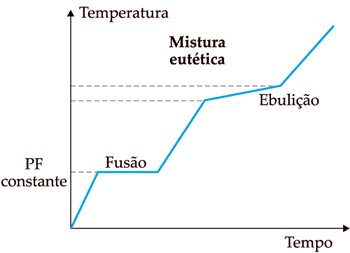 Gráficos (Txt) de uma mistura azeotrópica e uma mistura eutética[/caption]
Gráficos (Txt) de uma mistura azeotrópica e uma mistura eutética[/caption]
E a solubilidade dos compostos, como podemos analisar? Simples, basta entendermos alguns fatores que influenciam a solubilidade dos compostos, que chamaremos neste contexto de soluto (substância que será dissolvida), num dado solvente (substância presente em maior quantidade, que dissolverá o soluto).
Os fatores mais importantes são:- A natureza das partículas de solvente e soluto e as interações entre elas.- A temperatura na qual a solução é formada.- A pressão de um soluto gasoso.
O grau de solubilidade será relacionado com as ligações químicas que existem entre as moléculas de cada substância. Definiu- se a Regra da solubilidade:
Substâncias polares tendem a se dissolver em solventes polares, assim como substâncias apolares tendem a se dissolver em solventes apolares.Dessa forma, vários compostos inorgânicos, como ácidos, bases e sais, que são polares, se dissolvem em água, que é um solvente polar. Por outro lado, os compostos orgânicos, que geralmente são apolares, se dissolvem em solventes orgânicos, que também são apolares, em geral.
É possível notar que a água dissolve várias substâncias, sendo, por isso, chamada de solvente universal.
Saturação de uma solução
Quando adicionamos sal comum à água gradativamente em temperatura constante e agitando continuamente, é possível observar que, em dado momento, não ocorrerá a dissolução do sal, utilizando como exemplo o NaCl. Isso ocorrerá quando houver aproximadamente 360g de sal para cada litro de água. A partir desse ponto, dizemos que a solução se tornou saturada ou que a solução atingiu o seu ponto de saturação, pois qualquer quantidade de sal que for adicionada ao sistema irá precipitar ou formar corpo de fundo.
O ponto de saturação depende do soluto, do solvente e das condições físicas (a temperatura sempre influi e a pressão, em especial, em soluções que contêm gases). Este ponto é definido pelo coeficiente ou grau de solubilidade.
Coeficiente de Solubilidade
O Coeficiente de Solubilidade é a quantidade necessária de uma substância para saturar uma quantidade padrão de solvente, em determinada temperatura e pressão.
Por exemplo, os coeficientes de solubilidade em água a 0ºC:
- Para o NaCl, é igual a 357g/L- Para o CaSO4, é igual a 2 g/L
[caption id="attachment_65149" align="aligncenter" width="300"] Tabela de solubilidade[/caption]
Tabela de solubilidade[/caption]
Em função do ponto de saturação, podemos classificar as soluções em:
- Insaturadas: são aquelas que contêm menos soluto do que o estabelecido pelo coeficiente de solubilidade;- Saturadas: são aquelas que atingiram o coeficiente de solubilidade. Estão no limite da saturação;- Supersaturadas: ultrapassam o coeficiente de solubilidade.
[caption id="attachment_65146" align="aligncenter" width="227"] Soluções insaturada, saturada e supersaturada[/caption]
Soluções insaturada, saturada e supersaturada[/caption]
Dizemos que duas substâncias são totalmente miscíveis quando elas se dissolvem em qualquer quantidade, como é o caso da água com álcool. Nessas situações, o coeficiente de solubilidade é infinito.
Pelo contrário, existem substâncias que praticamente não se dissolvem num dado solvente, como ocorre com o cloreto de prata (AgCl), cujo coeficiente de solubilidade em água é de 0,014 g/L. Nesses casos, dizemos que a substância é insolúvel naquele solvente.
Lembra do fatores que modificam a solubilidade de um determinado soluto?Temperatura e pressão!
Temperatura
Na maioria das substâncias, há um aumento da solubilidade com o aumento da temperatura. Isso geralmente acontece quando o soluto é dissolvido com absorção de calor, o que chamamos de dissolução endotérmica. Por outro lado, existem substâncias que se dissolvem com liberação de calor e, por isso, tendem a ser menos solúveis com o aumento da temperatura, o que recebe o nome de dissolução exotérmica.[caption id="" align="aligncenter" width="423"]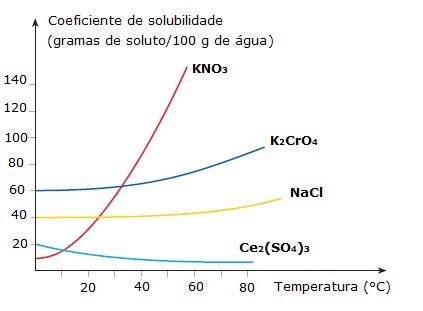 Gráfico Coeficiente de solubilidade x Temperatura[/caption]
Gráfico Coeficiente de solubilidade x Temperatura[/caption]
Perceba que as solubilidades do nitrato de potássio (KNO3), do cromato de potássio (K2CrO4) e do cloreto de sódio (NaCl) aumentam com a elevação da temperatura (curva ascendente). Em contrapartida, o sulfato de cério (Ce2(SO4)3) tem sua solubilidade diminuída com o aumento da temperatura (curva descendente).
Pressão
A pressão tem grande influência nas soluções que contêm gases. A solubilidade de gases em solventes líquidos muito depende da pressão. Quando aumentamos a pressão sobre o gás, de certa forma, o gás é “empurrado” para dentro do líquido, ou seja, sua solubilidade aumenta.
Quando o gás não reage com o líquido da solução, a lei de Henry explica a influência da pressão nesse sistema, dizendo que:
A solubilidade de um gás num líquido é diretamente proporcional à pressão sobre o gás, em temperatura constante.Lei de Henry
S = k.P, onde k é uma constante de proporcionalidade que depende da natureza do gás e do líquido, e, também, da própria temperatura.
[caption id="" align="aligncenter" width="614"]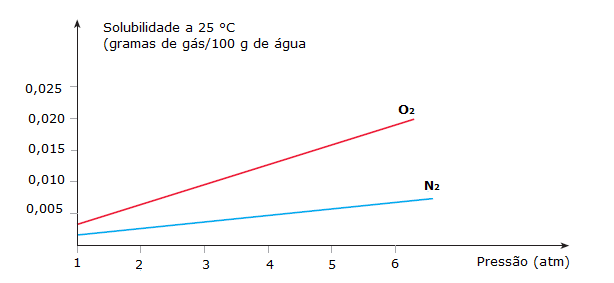 Gráfico Coeficiente de solubilidade x Pressão[/caption]
Gráfico Coeficiente de solubilidade x Pressão[/caption]
Exercícios
1. A tabela a seguir fornece os valores de solubilidade do cloreto de sódio e do hidróxido de sódio, em água, a diferentes temperaturas.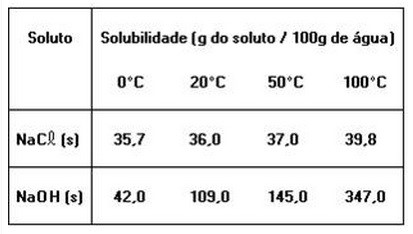
As informações anteriores e os conhecimentos sobre soluções permitem concluir:01 - Soluções são misturar homogêneas02 - Solução saturada é uma mistura heterogênea04 - O hidróxido de sódio é mais solúvel em água do que o cloreto de sódio08 - Soluções concentradas são soluções saturadas16 - Quando se separa o soluto do solvente, obtêm-se substâncias diferentes daquelas que foram inicialmente misturadas.32 - Adicionando-se 145 g de hidróxido de sódio a 100 g de água, a 20º C, obtém-se um sistema bifásico, que, após aquecido a temperaturas acima de 50º C, apresenta-se monofásico.
Soma = ?
2. O gráfico apresenta a curva de solubilidade de um sal Ax2.
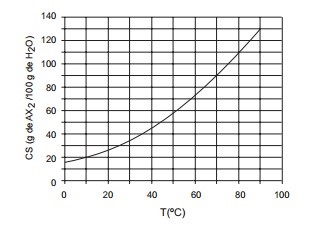
Quando uma solução aquosa saturada de Ax2, a 70º C contendo 50 g de água é resfriada para 10º C, quais são, em gramas, a massa de sal cristalizada e a massa que permanece em solução?a) 25 e 20b) 30 e 15c) 35 e 10d) 35 e 15e) 40 e 10
3. Seis soluções aquosas de nitrato de sódio, NaNO3, numeradas de I a VI, foram preparadas, em diferentes temperaturas, dissolvendo-se diferentes massas de NaNO3 em 100 g de água. Em alguns casos, o NaNO3 não se dissolveu completamente. Este gráfico representa a curva de solubilidade de NaNO3, em função da temperatura, e seis pontos, que correspondem aos sistemas preparados:
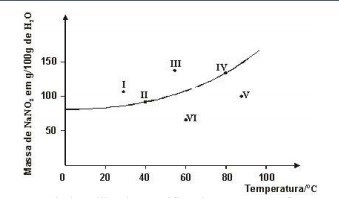
A partir da análise desse gráfico, identifique os dois sistemas em que há precipitado:a) I e IIb) I e IIIc) IV e Vd) V e VI
4.Um professor realizou várias experiências (a 20°C e 1 atm) e organizou a seguinte tabela:
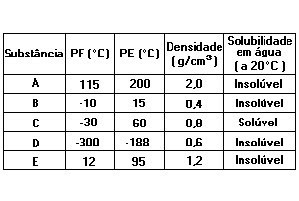
De acordo com a tabela, assinale a afirmativa INCORRETA:a) O estado físico da substância D, à temperatura ambiente, é gasoso.b) Se misturarmos a substância B com a substância D, à temperatura ambiente, forma-se uma mistura homogênea.c) A substância mais volátil, à temperatura ambiente, é a A.d) Se misturarmos as substâncias A, C e água, forma-se um sistema difásico.e) O processo mais adequado para separarmos uma mistura da substância C com a água, à temperatura ambiente, é destilação simples.
5. Os sistemas seguintes devem ser classificados como:
1) sistema polifásico e mistura heterogênea2) sistema polifásico e espécie química simples3) sistema polifásico e espécie química composta4) sistema monofásico e mistura homogênea5) sistema monofásico e espécie química simples6) sistema monofásico e espécie química composta
( ) gelo fundente( ) álcool a 96º GL( ) ar atmosférico (isento de poeira)( ) ferro durante a fusão( ) granito( ) oxigênio parcialmente liqüefeito( ) propano (C3H8)( ) ozônio
A ordem das lacunas, de cima para baixo, é:a) 3 - 4 - 6 - 2 - 1 - 2 - 6 - 5b) 3 - 4 - 4 - 2 - 1 - 2 - 6 - 5c) 1 - 4 - 4 - 1 - 1 - 2 - 6 - 5d) 3 - 4 - 4 - 1 - 2 - 6 - 5 - 5e) 4 - 3 - 2 - 6 - 1 - 5 - 2 – 5
