Estudar Termoquímica é uma parte essencial da preparação para o Enem e para qualquer vestibular relacionado à área de Ciências da Natureza e suas Tecnologias.
Essa disciplina aborda as transformações de energia que ocorrem nas reações químicas, proporcionando uma compreensão profunda sobre como a termodinâmica governa o comportamento das substâncias. Compreender a Termoquímica é crucial, não apenas para responder a questões específicas sobre o tema, mas também para abordar questões interdisciplinares que envolvem a química, a física e a biologia.
Neste contexto, para auxiliar na fixação do tema, selecionamos algumas questões relacionadas à Termoquímica que podem ser usadas como ferramentas de estudo e treinamento. A resolução dessas questões não apenas fortalecerá o entendimento do assunto, mas também preparará os estudantes para enfrentar com confiança os desafios que a Termoquímica pode apresentar no ENEM.
Continue a leitura e confira a lista de exercícios de termoquímica que separamos:
Exercícios de Termoquímica
Questão 1
(UFRRJ) Desde a pré-história, quando aprendeu a manipular o fogo para cozinhar seus alimentos e se aquecer, o homem vem percebendo sua dependência cada vez maior das várias formas de energia. A energia é importante para uso industrial e doméstico, nos transportes, etc.Existem reações químicas que ocorrem com liberação ou absorção de energia, sob a forma de calor, denominadas, respectivamente, como exotérmicas e endotérmicas. Observe o gráfico a seguir e assinale a alternativa correta:
 a) O gráfico representa uma reação endotérmica.b) O gráfico representa uma reação exotérmica.c) A entalpia dos reagentes é igual à dos produtos.d) A entalpia dos produtos é maior que a dos reagentes.e) A variação de entalpia é maior que zero.
a) O gráfico representa uma reação endotérmica.b) O gráfico representa uma reação exotérmica.c) A entalpia dos reagentes é igual à dos produtos.d) A entalpia dos produtos é maior que a dos reagentes.e) A variação de entalpia é maior que zero.Questão 2
(PUC-MG) Sejam dadas as equações termoquímicas, todas a 25 ºC e 1 atm:I- H~2~(g)+ ½ O~2~(g) →H~2~O(l) ∆H = -68,3 Kcal/molII- 2Fe(s)+ 3/2 O~2~(g)→Fe~2~O~3~(s) ∆H = -196,5 Kcal/molIII- 2Al(s)+ 3/2 O~2~(g)→Al~2~O~3~(s) ∆H = -399,1 Kcal/molIV – C(grafite)+ O~2~(g)→ CO~2~(g) ∆H = -94,0 Kcal/molV- CH~4~(g) + O~2~(g) → CO~2~(g)+ H~2~O(l) ∆H = -17,9 Kcal/mol
Exclusivamente sob o ponto de vista energético, das reações acima, a que você escolheria como fonte de energia é:
a)Ib)IIc) IIId) IVe ) V
Aproveite para conferir o mapa mental de TermoquímicaQuestão 3
(Fuvest) Considere os dados da tabela abaixo, a 25 ºC e 1 atm. a) Calcule a variação de entalpia (em kJ/mol) quando a base reage com o ácido para formar o correspondente sal.b) Essa reação de salificação é exotérmica ou endotérmica? Por quê?
a) Calcule a variação de entalpia (em kJ/mol) quando a base reage com o ácido para formar o correspondente sal.b) Essa reação de salificação é exotérmica ou endotérmica? Por quê?Questão 4
(ENEM) Um incêndio atingiu uma fábrica de resíduos industriais em Itapevi, na Grande São Paulo. O local armazenava três toneladas de fosfeto de alumínio . De acordo com a Companhia Ambiental do Estado de São Paulo (Cetesb), o fosfeto de alumínio reagiu com a água usada para apagar as chamas, produzindo hidróxido de alumínio e fosfina.A fosfina é um gás tóxico, incolor, e não reage com a água, porém reage rapidamente com o oxigênio liberando calor e produzindo pentóxido de difosfóro. Segundo os médicos, a inalação do pode causar queimadura tanto na pele quanto nas vias respiratórias devido à formação de ácido fosfórico
Os gráficos 1, 2 e 3 representam a variação da energia em função do caminho da reação para três transformações químicas, sendo o reagente e o produto de cada reação.

Entre os gráficos 1, 2 e 3, aquele que representa corretamente a reação da fosfina com o oxigênio, descrita no texto, é o
a) gráfico 1, pois a reação é endotérmica e apresenta rH0 < 0
b) gráfico 1, pois a reação é exotérmica e apresenta ΔrH0 < 0
c) gráfico 2, pois a reação é endotérmica e apresenta ΔrH0 > 0
d) gráfico 2, pois a reação é exotérmica e apresenta ΔrH < 0
e) gráfico 3, pois a reação é endotérmica e apresenta ΔrH0 > 0
Questão 5(Enem, 2016)Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:
Mg(s) + 2 H2O → Mg(OH)2(s) + H2 + 350kJ
O aquecimento dentro da bolsa ocorre por causa da:
a) redução sofrida pelo oxigênio, que é uma reação exotérmica.
b) oxidação sofrida pelo magnésio, que é uma reação exotérmica.
c) redução sofrida pelo magnésio, que é uma reação endotérmica.
d) oxidação sofrida pelo hidrogênio, que é uma reação exotérmica.
e) redução sofrida pelo hidrogênio, que é uma reação endotérmica.
Questão 6
(Enem PPL, 2020)A água sofre transições de fase sem que ocorra variação da pressão externa. A figura representa a ocorrência dessas transições em um laboratório.
Tendo como base as transições de fase representadas (1 a 4), a quantidade de energia absorvida na etapa 2 é igual à quantidade de energia:
a) liberada na etapa 4
b) absorvida na etapa 3
c) liberada na etapa 3
d) absorvida na etapa 1
e) liberada na etapa 1
Questão 7
Hot pack e cold pack são dispositivos que permitem, respectivamente, aquecer ou resfriar objetos rapidamente e nas mais diversas situações. Esses dispositivos geralmente contêm substâncias que sofrem algum processo quando eles são acionados. Dois processos bastante utilizados nesses dispositivos e suas respectivas energias estão esquematizados nas equações 1 e 2apresentadas a seguir.
De acordo com a notação química, pode-se afirmar que as equações 1 e 2 representam processos de:
a) dissolução, sendo a equação 1 para um hot pack e a equação 2 para um cold pack.
b) dissolução, sendo a equação 1 para um cold pack e a equação 2 para um hot pack.
c) diluição, sendo a equação 1 para um cold pack e a equação 2 para um hot pack.
d) diluição, sendo a equação 1 para um hot pack e a equação 2 para um cold pack.
Questão 8
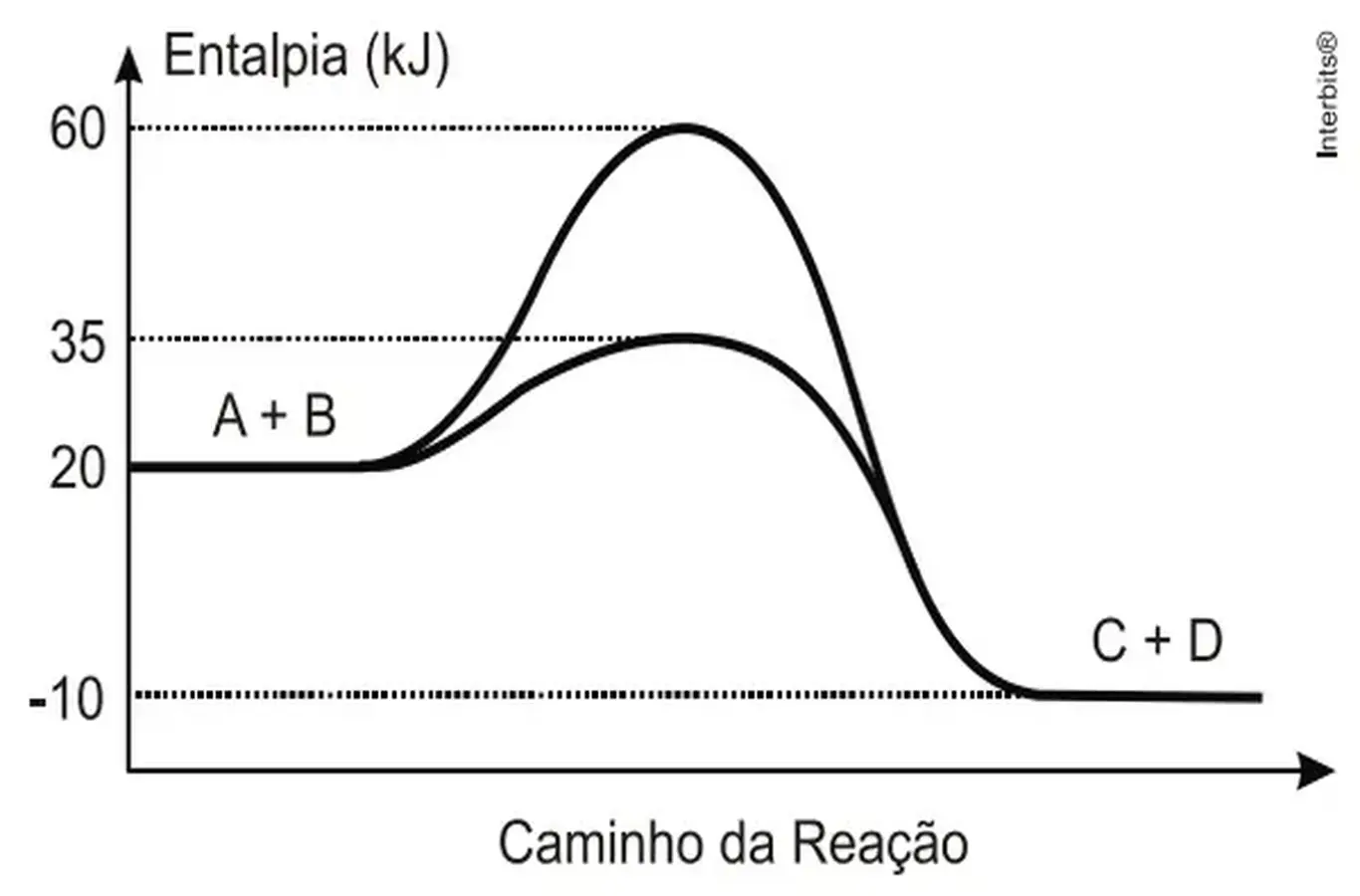
(UEG, 2013)Durante a manifestação das reações químicas, ocorrem variações de energia. A quantidade de energia envolvida está associada às características químicas dos reagentes consumidos e dos produtos que serão formados.O gráfico abaixo representa um diagrama de variação de energia de uma reação química hipotética em que a mistura dos reagentes A e B levam à formação dos produtos C e D.
Com base no diagrama, no sentido direto da reação, conclui-se que a:
a) energia de ativação da reação sem o catalisador é igual a 15 kJ.
b) energia de ativação da reação com o catalisador é igual a 40 kJ.
c) reação é endotérmica.
d) variação de entalpia da reação é igual a -30 kJ.
e) variação de entalpia da reação é igual a -70 kJ.
Questão 9
Analise as equações termoquímicas.C + 3/2 O2 + Ca → CaCO3; ΔH = –1 207 kJ/molC + O2 → CO2; ΔH = –394 kJ/molCa + 1/2 O2 → CaO; ΔH = – 634 kJ/mol
A partir dessas equações, pode-se prever que o ΔH da reação de decomposição do calcário que produz cal viva (cal virgem) e dióxido de carbono seja igual a:
a) +573 kJ/mol.
b) +1 601 kJ/mol.
c) –2 235 kJ/mol
d) –1 028 kJ/mol.
e) +179 kJ/mol.
Questão 10
(Enem PPL, 2019)O etanol é um combustível renovável obtido da cana-de-açúcar e é menos poluente do que os combustíveis fósseis, como a gasolina e o diesel. O etanol tem densidade 0,8 g/cm3 , massa molar 46 g/mol e calor de combustão aproximado de -1.300kJ/mol. Com o grande aumento da frota de veículos, tem sido incentivada a produção de carros bicombustíveis econômicos, que são capazes de render até 20 km/L em rodovias, para diminuir a emissão de poluentes atmosféricos. O valor correspondente à energia consumida para que o motorista de um carro econômico, movido a álcool, percorra 400km na condição de máximo rendimento é mais próximo de:a) 565 MJ
b) 452 MJ
c) 520 MJ
d) 390 MJ
e) 348 MJ
Questão 11
(Enem PPL, 2015)O urânio é um elemento cujos átomos contêm 92 prótons, 92 elétrons e entre 135 e 148 nêutrons. O isótopo de urânio 235U é utilizado como combustível em usinas nucleares, onde, ao ser bombardeado por nêutrons, sofre fissão de seu núcleo e libera uma grande quantidade de energia (2,35 x 1010 kj/mol). O isótopo 235U ocorre naturalmente em minérios de urânio, com concentração de apenas 0,7%. Para ser utilizado na geração de energia nuclear, o minério é submetido a um processo de enriquecimento, visando aumentar a concentração do isótopo 235U para, aproximadamente, 3% nas pastilhas. Em décadas anteriores, houve um movimento mundial para aumentar a geração de energia nuclear buscando substituir, parcialmente, a geração de energia elétrica a partir da queima do carvão, o que diminui a emissão atmosférica de CO2 (gás com massa molar igual a 44 g/mol). A queima do carvão é representada pela equação química:
C(s) + O2(g) → CO2(g) ΔH = −400 kJ/mol
Qual é a massa de CO2, em toneladas, que deixa de ser liberada na atmosfera, para cada 100g de pastilhas de urânio enriquecido utilizadas em substituição ao carvão como fonte de energia?
a) 2,10
b) 7,70
c) 9,00
d) 33,0
e) 300
Questão 12
O biogás pode substituir a gasolina na geração de energia. Sabe-se que 60%, em volume, do biogás são constituídos de metano, cuja combustão completa libera cerca de 900 kJ/mol.Uma usina produtora gera 2.000 litros de biogás por dia. Para produzir a mesma quantidade de energia liberada pela queima de todo o metano contido nesse volume de biogás, será necessária a seguinte quantidade aproximada (em litros) de gasolina:
a) 0,7
b) 1,0
c) 1,7
d) 3,3
e) 4,5
Questão 13
(Enem/2019)
Glicólise é um processo que ocorre nas células, convertendo glicose em piruvato. Durante a prática de exercícios físicos que demandam grande quantidade de esforço, a glicose é completamente oxidada na presença de O2. Entretanto, em alguns casos, as células musculares podem sofrer um déficit de O2 e a glicose ser convertida em duas moléculas de ácido lático. As equações termoquí micas para a combustão dá glicose e do ácido lático são, respectivamente, mostradas a seguir:
C6H12O6(s) + 6 O2(g) → 6 CO2(g) + 6 H2O(ℓ) ΔCH = −2.800 kJ
CH3CH(OH)COOH(s) + 3 O2(g) → 3 CO2(g) + 3 H2O(ℓ) ΔCH = −1.344 kJ
O processo anaeróbico é menos vantajoso energeticamente porque:
a)libera 112 kJ por mol de glicose;
b) libera 467 kJ por mol de glicose;
c) libera 2 688 kJ por mol de glicose;
d) absorve 1 344 kJ por mol de glicose;
e)absorve 2 800 kJ por mol de glicose;
Questões 14
(UEG - 2020) O álcool etílico combustível, mais popularmente conhecido como etanol, é uma fonte de energia limpa e renovável, proveniente de várias matérias-primas como beterraba, milho e cana-de-açúcar, sendo esta última o insumo agrícola mais utilizado na produção de etanol no Brasil.Ao contrário dos combustíveis fósseis, o etanol é uma fonte de energia natural e limpa, pois sua composição não contém poluentes que sejam prejudiciais à saúde e ao meio ambiente. Desde o momento em que brota no campo, a cana-de-açúcar passa a absorver parte do gás carbônico utilizado na produção e no consumo do etanol.
A crescente fabricação brasileira de carros flex (movidos a gasolina e etanol), iniciada em 2003, foi o que permitiu o avanço da utilização do etanol no Brasil. Atualmente, 97,7% dos carros produzidos no país podem ser abastecidos com etanol ou gasolina, puros ou misturados em qualquer proporção.
A equação química que representa o processo de combustão do etanol encontra-se mostrada a seguir.
+ 3 2 → 2 + 3Sabendo-se que a entalpia de formação da H2O(l) é -286 kJ/mol; que a do CO2(g) é - 393,5 kJ/mol e que a do C2H6O(l) é - 277,6 kJ/mol, verifica-se que a energia liberada na combustão de 1,0 mol de etanol é:
a)-1367,4 kJ/mol
b)-401,9 kJ/mol
c) +401,9 kJ/mol
d) -348,6 kJ/mol
e) +1367,4 kJ/mol
Questão 15
Normalmente uma reação química libera ou absorve calor. Esse processo é representado no seguinte diagrama, considerando uma reação específica.
Com relação a esse processo, assinale a equação química correta:
a) H2(g) + 12 O2(g) → H2O(ℓ) − 68,3 kcal
b) H2O(ℓ) − 68,3 kcal → H2(g) + 12 O2(g)
c) H2O(ℓ) → H2(g) + 12 O2(g) + 68,3 kcal
d) H2(g) + 12 O2(g) → H2O(ℓ) + 68,3 kcal
e) 2 H2O(ℓ) → H2(g) + 12 O2(g) + 68,3 kcal
Questão 16
(Unicamp 2003)Os alimentos, além de nos fornecerem as substâncias constituintes do organismo, são também fontes de energia necessária pra nossas atividades.
Podemos comparar o balanço energético de um indivíduo após um dia de atividades, da mesma forma que comparamos os estados final e inicial de qualquer processo químico.
O gasto total de energia (em kJ) por um indivíduo pode ser considerado como a soma de três usos corporais de energia:
- gasto metabólico de repouso (4,2kJ/kg por hora);
- gasto energético pra digestão e absorção dos alimentos, correspondente a 10% da energia dos alimentos ingeridos;
- atividade física, que, pra uma atividade moderada representa 40% do gasto metabólico de repouso.
- a) Qual seria o gasto energético total de um indivíduo com massa corporal de 60kg, com atividade moderada e que ingere o equivalente a 7600kJ por dia?
- b) Considerando-se que 450g de massa corporal correspondem a aproximadamente 15000kJ, qual é o ganho (ou perda) deste indivíduo por dia, em gramas?
Questão 17
Enem 2021
Na cidade de São Paulo, as ilhas de calor são responsáveis pela alteração da direção do fluxo da brisa marítima que deveria atingir a região de mananciais. Mas, ao cruzar a ilha de calor, a brisa marítima agora encontra um fluxo de ar vertical, que transfere para ela energia térmica absorvida das superfícies quentes da cidade, deslocando-a para altas altitudes.Dessa maneira, há condensação e chuvas fortes no centro da cidade, em vez de na região de mananciais. A imagem apresenta os três subsistemas que trocam energia nesse fenômeno.

No processo de fortes chuvas no centro da cidade de São Paulo, há dois mecanismos dominantes de transferência de calor: entre o Sol e a ilha de calor, e entre a ilha de calor e a brisa marítima.
VIVEIROS, M. Ilhas de calor afastam chuvas de represas. Disponível em: www2.feis.unesp.br. Acesso em: 3 dez. 2019 (adaptado).
Esses mecanismos são, respectivamente,
- a) irradiação e convecção.
- b) irradiação e irradiação.
- c) condução e irradiação.
- d) convecção e irradiação.
- e) convecção e convecção.
Gabarito
1. B2. C3. a) ∆H= –176 kJ/mol; b) Exotérmica.4. B5. B6.E7. A8. E9. E10. B11. D12. B13. A14. A15. D16.- a) O gasto total que se gastou em energia = 6048 + 760 + 2419,2 = 9227,2kJ;
- b) x = 48,8g corresponde a massa corpórea que foi perdida.
Gostou da nossa lista de exercícios sobre Termoquímica? aproveite para fazer questões antigas de provas do Enem e melhore sua preparação!
E se você estiver procurando um curso preparatório para o Enem, confirma o cursinho da Descomplica!