Introdução à estequiometria
Volume de CO2 obtido
Número de moléculas de CO2
Reagente em excesso e massa do produto
Massa de H2SO4 formada
Cálculo estequiométrico ou estequiometria é o cálculo das quantidades de reagentes e/ou produtos das reações químicas baseados nas leis ponderais e proporções químicas.
Na estequiometria temos que estar cientes das informações quantitativas que uma reação química pode representar, por exemplo:

De acordo com as leis das reações, as proporções acima são constantes, e isso permite que eu monte uma regra de três para calcular as quantidades envolvidas numa reação genérica. Por exemplo:
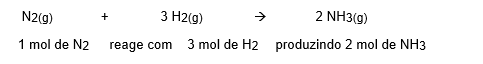
Sendo assim, caso eu queira saber quantos mol de amônia eu produzo com 10 mol de N2 basta eu montar uma regra de simples partindo da reação dada e relacionando o dado da questão(10 mol) com o X.
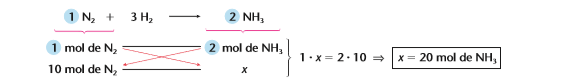
Portanto, se eu sei que 1 mol de N2produzem 2 mol de NH3eu posso chegar a conclusão que com 10 mol de N2eu produzo 20 mol de NH3.
Analogamente podemos utilizar qualquer uma das unidades apresentadas como dados ta questão, por exemplo usando a massa:
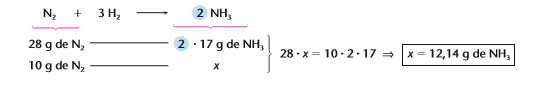
Como 1 mol de N2 equivale a 28g e produzem 34g de NH3, com uma regra de três simples consigo descobrir quanto de NH3 eu consigo produzir utilizando apensas 10g de N2.
Resumindo:
1º) Escrever a equação química mencionada no problema.
2º) Balancear ou acertar os coeficientes dessa equação (lembre-se de que os coeficientes indicam a proporção em mols existente entre os participantes da reação).
3º) Estabelecer uma regra de três entre o dado e a pergunta do problema, obedecendo aos coeficientes da equação, que poderá ser escrita em massa, ou em volume, ou em mols, conforme as conveniências do problema.
Casos gerais
1.1) Quando o dado e a pergunta são expressos em massa
Calcular a massa de amônia (NH3) obtida a partir de 3,5 g de nitrogênio gasoso(N2) (massas atômicas: N = 14; H = 1).
Resolução:
1 N2(g)+ 3 H2(g) -> 2 NH3(g)
1 mol de N2 = 28g
2 mol de NH3 = 2x17g(14+3) = 34g , logo...
28g de N2 _________34g de NH3
3,5g de N2 ______ X de NH3
X = 4,25g de NH3
Neste exemplo, a regra de três obtida da equação foi montada em massa (gramas), pois tanto o dado como a pergunta do problema estão expressos em massa.
1.2) Quando o dado é expresso em massa e a pergunta em volume(ou vice-versa)
Calcular o volume de gás carbônico obtido, nas condições normais de pressão e temperatura, utilizando de 290 g de gás butano (massas atômicas: C = 12; O = 16; H = 1).
Resolução:
C4H10(g)+ 13 O2(g) -> 4 CO2(g) + 5 H2O(g)
2
Lembrando a definição de Condições Normais de Temperatura e Pressão(P =1 atm ; T = 0ºC):
1 mol de qualquer gás na CNTP ocupam 22,4L.
58g de C4H10 __________ 4 x 22,4L de CO2
290g de C4H10_______ X
X = 448L de CO2 (Nas CNTP)
Agora a regra de três é, “de um lado”, em massa (porque o dado foi fornecido em massa) e, “do outro lado”, em volume (porque a pergunta foi feita em volume).
1.3) Quando o dado e a pergunta são expressos em volume
Um volume de 15 L de hidrogênio(H2), medido a 15 ° C e 720 mmHg, reage completamente com cloro. Qual é o volume de gás clorídrico(HCl) produzido na mesma temperatura e pressão?
Resolução:
H2(g) + Cl2(g) -> 2 HCl(g)
1 volume de H2 -- produz --> 2 volumes de HCl
1L de H2 ________ 2L de HCl
15 de H2 ________ V de HCl
V = 30L de HCl (a 15 ° C e 720 mmHg, ou seja, fora das CNTP)
O cálculo estequiométrico entre volumes de gases é um cálculo simples e direto, desde que os gases(reagente e produto) estejam nas mesmas condições de pressão e temperatura.
1.4) Quando o dado é expresso em massa e a pergunta em mols (ou vice-versa)
Quantos mols de gás oxigênio são necessários para produzir 0,45 gramas de água?
(Massas atômicas: H = 1; O = 16)
Resolução:
H2(g) + O2(g) -> 2 H2O(g)
1 mol de O2________2 x 18g de H2O
X mol de O2________ 0,45g de H2O
X = 0,0125 mol de O2 ou 1,25 x 10² mol de O2
1.5) Quando o dado é expresso em massa e a pergunta em número de partículas(ou vice-versa)
Quantas moléculas de gás carbônico podem ser obtidas pela queima completa de 4,8 g de carbono puro?
(Massa atômica: C = 12)
Resolução:
C + O2 -> CO2
12g de C _______ 6,02 x 10²³moléculas de CO2
4,8g de C _______ X moléculas de CO2
X = 2,4 x 10²³moléculas de CO2
1.6) Havendo duas ou mais perguntas
(Neste caso, teremos uma resolução para cada uma das perguntas feitas)
Quais são as massas de ácido sulfúrico e hidróxido de sódio necessárias para preparar 28,4 g de sulfato de sódio? (Massas atômicas: H = 1; O = 16; Na = 23; S = 32)
Para a massa do ácido sulfúrico(H2SO4):
H2SO4(aq)+ 2 NaOH(aq) -> Na2SO4(aq)+2 H2O(liq)
98g de H2SO4 _____ 142g de Na2SO4
X de H2SO4 _____ 28,4g de Na2SO4
X = 196g de de H2SO4
Para a massa do Hidróxido de sódio(NaOH):
2 x 40g de NaOH ______ 142g de Na2SO4
Y de NaOH ______ 28,4g de Na2SO4
Y =16gde NaOH