Questão sobre Aspectos Macroscópicos
Questão 2
Questão 3
Questão 4
Questão 5 e 6
Questão 7
Questão 8
Questão 9
Questão 10
A Química é a ciência que estuda a constituição da matéria, que nada mais é que tudo aquilo que possui massa e ocupa lugar no espaço, sua estrutura interna e as relações entre os diversos tipos de materiais encontrados na natureza, além de determinar suas propriedades, sejam elas físicas como por exemplo, cor, ponto de fusão, densidade e etc, ou químicas, que são as transformações de uma substância em outra.
Fenômeno físico: é toda transformação da matéria que ocorre sem alteração de sua composição química. Não altera a natureza da matéria, podendo alterar a sua forma, tamanho, aparencia e/ou estado físico.
Exemplo: as mudanças de estado físico (fusão, condensação), quebrar um lápis em vários pedaços.

mudanças de estados físicos são fenômenos físicos
Fenômeno químico: é todo aquele que ocorre com a formação de novas substâncias. Há a formação de substâncias com propriedades diferentes. Geralmente são notadas pela mudança de cor, formação de gases, formação de sólido e/ou aparecimento de chama ou luminosidade.
Exemplo: reações químicas (ferrugem, fotossíntese e combustão).

A combustão é uma reação química, portanto um fenômeno químico
Propriedades específicas da matéria
Propriedades Gerais da matéria
São as características que toda matéria apresenta, independentemente do seu estado físico.
Inércia: Uma matéria sempre apresenta a tendência de manter o seu estado, seja de repouso, seja de movimento.
Massa: Fisicamente, massa é uma grandeza que indica a medida da inércia ou da resistência de um corpo de ter seu movimento acelerado. Porém, podemos, de uma forma geral, associar a massa à quantidade de partículas existentes em uma matéria.
Volume: É o espaço que uma matéria ocupa.
Impenetrabilidade: Duas matérias não podem ocupar o mesmo espaço ao mesmo tempo.
Compressibilidade: É a característica que a matéria apresenta de diminuir o espaço que estava ocupando quando submetida a uma força externa.
Elasticidade: É a característica que uma matéria tem de voltar à sua forma original quando uma força externa a estica ou comprime.
Divisibilidade: É a capacidade que a matéria possui de ser dividida inúmeras vezes sem deixar de ser o que ela é.
Propriedades físicas
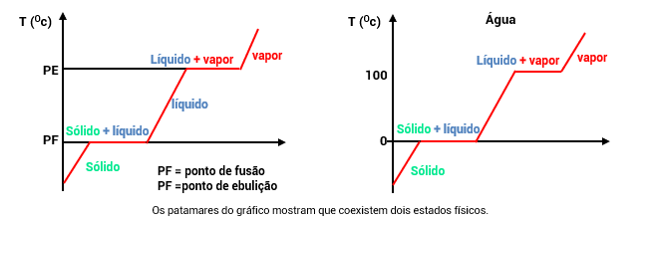
Ponto de Fusão (PF): É a temperatura em que ocorre a passagem do estado sólido para o líquido a uma determinada pressão.
Ponto de Ebulição (PE): É a temperatura em que ocorre a passagem do estado líquido para o gasoso a uma determinada pressão.
Densidade: É a relação entre a quantidade de matéria em massa e o seu volume. A densidade absoluta de um corpo é igual a m/V. Se a massa é medida em gramas e o volume em centímetros cúbicos, a densidade é obtida em gramas por centímetros cúbicos.
Solubilidade: É a característica que uma determinada matéria apresenta de dissolver outra. Por exemplo, a solubilidade do salde coisinha em água é encontrada pela relação da quantidade de sal que é solubilizado em determinada quantidade de água.
Dureza: É a capacidade que um material tem de riscar outro. Por exemplo, o diamante é considerado o material com maior dureza conhecida, pois ele consegue risca quaisquer outros materiais.
Tenacidade: Algumas pessoas acabam confundindo tenacidade com dureza, mas tenacidade é a capacidade que uma matéria tem de resistir ao impacto com outra matéria. Quando uma pedra é arremessada no vidro, este se quebra, ou seja, a pedra é mais tenaz que o vidro.
Propriedades Organolépticas
É a propriedade que a matéria tem de estimular pelo menos um dos nossos cinco sentidos.
Substância x Mistura
Substância pura (ou Substância ou Espécie Química): é formada exclusivamente por partículas (moléculas ou átomos) quimicamente iguais, ou melhor, de uma única.
As substâncias puras podem ser:
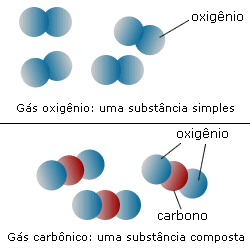
Substâncias Simples: formadas por átomos iguais ou átomos do mesmo elemento químico.
Exemplo: o gás oxigênio (O2), que é uma substância pura simples, pois é formado apenas pelo elemento oxigênio.
Substâncias Compostas: formadas por átomos diferentes ou átomos de diferentes elementos químicos.
Exemplo: água (H2O), que é uma substância pura composta, pois contém dois elementos em suas moléculas que são o hidrogênio e o oxigênio.
Mistura: é a reunião de duas ou mais substâncias sem que haja reação química entre elas, e mantendo cada qual suas propriedades. As misturas podem ser classificadas em:
Mistura homogênea: apresentam uma única fase, ou seja, monofásica.
Exemplo: sal + água; açúcar + água; álcool + água.
Mistura heterogêneas: podem apresentar duas ou mais fases. São denominadas polifásicas.
Exemplo: areia + água; óleo + água; talco + água.
Qualquer porção do Universo submetida a análise é denominada sistema, e tudo que a rodeia é chamado de meio ambiente, esses sistemas podem ser divididos em:
• Sistema aberto: tem a capacidade de trocar energia e matéria com o meio;
• Sistema fechado: tem a capacidade de trocar somente energia com o meio;
• Sistema isolado: não realiza nenhuma troca com o meio, esse tipo de sistema só existe de forma teórica.
Atenção: Sistema homogêneo: É todo sistema que possui somente uma fase e necessariamente precisar ser uma mistura. Exemplo: cachaça, formada por água e álcool.
Sistema heterogêneo: É todo sistema que possui duas ou mais fases e não necessariamente precisa ser uma mistura. Exemplo: Água + Gelo
GRÁFICOS:
Substâncias Puras
As transformações físicas das substâncias puras ocorrem a temperaturas constantes, como vemos a seguir:
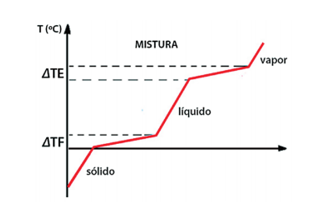
Misturas
As transformações físicas das misturas não ocorrem a temperaturas constantes, como mostra o gráfico a seguir.
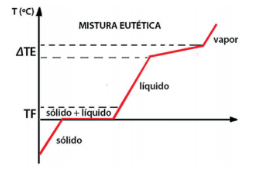
Misturas Eutéticas
Essas misturas comportam-se como se fossem substâncias puras durante sua fusão, ou seja, apresentam transformação física constante durante a sua fusão. Exemplo: solda (estanho + chumbo)
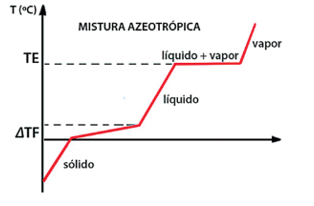
Misturas Azeotrópicas
Essas misturas comportam-se como se fossem substâncias puras durante sua ebulição, ou seja, apresentam transformação física constante durante a sua ebulição. Exemplo: solução alcoólica (96% de álcool + 4% de água).
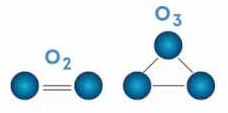
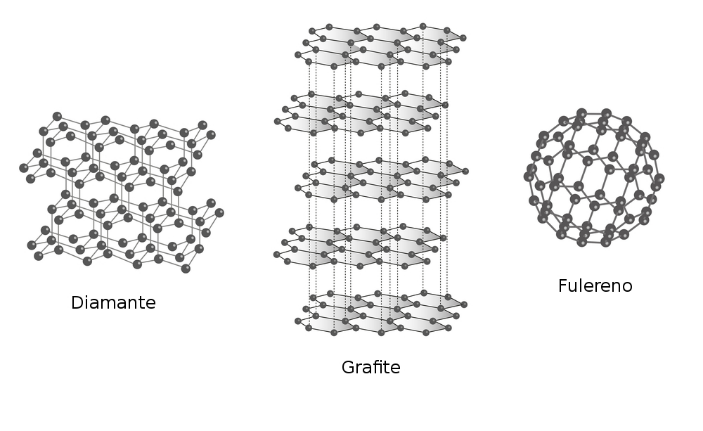
Alotropia
É quando um mesmo elemento é capaz de formar substâncias simples diferentes, tais substâncias são denominadas alótropos ou formas alotrópicas. A alotropia por ser classificada de duas formas:
Por estrutura – Ocorre quando um mesmo elemento é capaz de se ligar de formas diferentes, formando assim composto com propriedades distintas.
Exemplo: C diamante, C grafite e C fulereno.
Por atomicidade – Ocorre quando o mesmo elemento forma substâncias simples diferentes por conter diferentes quantidades de átomos na sua estrutura.
Exemplo:
O2 – Gás oxigênio
O3 – Gás oxônio