Análise da força de um ácido
Potencial hidrogeniônico (pH) em reações químicas
Indicador de ácido base
pH em solução tampão
pH e kps
A matéria de equilíbrio químico estuda as reações reversíveis em geral, com as características que são comuns a toda e qualquer reação química. Já o equilíbrio iônico estuda as reações reversíveis que envolvem íons, com suas características específicas, que precisam de fato ser analisadas com maior atenção. Por isso, fez-se esta separação. A partir de agora, vamos olhar para essas particularidades das reações iônicas.
Constante de ionização
Uma das particularidades elementares dessas reações é que se tratam de ionizações (no caso de compostos covalentes, como os ácidos) ou dissociações (no caso de compostos iônicos, como os sais e as bases). Por isso, passamos a chamar a constante de equilíbrio (Kc) de constante de ionização (Ki).
Generalizando, temos que:
CA (aq) ⇌ C+ (aq) + A– (aq)
Ki = [C+][ A–] / [CA]
Onde:
CA = composto em solução não ionizado/dissociado;
C+ = cátion do composto ionizado/dissociado;
A– = ânion do composto ionizado/dissociado.
Obs: Não calculamos Kp em equilíbrios iônicos, pois este tipo de constante só se aplica a sistemas gasosos, e estamos estudando sistemas aquosos.
Grau de ionização
Existem algumas reações reversíveis iônicas que envolvem compostos com propriedades especiais e, portanto, muito importantes no nosso dia a dia. São eles os ácidos e as bases, os quais se ionizam em água, liberando H+ e OH−, respectivamente.
É de extrema importância, para entendermos essa matéria, termos em mente o seguinte:
a. Quem confere caráter ácido a uma solução são os íons H+. Sendo assim, quanto maior for a concentração de H+ na solução, maior será seu grau de acidez.
Exemplo: Se eu coloco certa quantidade de HCl (ácido clorídrico) em solução aquosa, ele se ioniza, liberando os íons abaixo, o que faz aumentar a concentração de H+ na solução, acidificando-a. Mas ele não se ioniza totalmente, porque o sentido inverso da reação ocorre ao mesmo tempo: uma parte dos íons liberados se combinam, formando HCl novamente, do qual parte se ioniza, liberando íons, dos quais uma parte se combina, e assim sucessivamente, até que as concentrações de todos os compostos se mantenham constantes, como acontece com toda reação reversível.
HCl (aq) ⇌ H+(aq) + Cl−(aq)
Na solução aquosa equilibrada de HCl, 90% das moléculas desse ácido estão ionizadas, isto é, separadas em íons H+ e Cl−. 90% se tratam da grande maioria das moléculas postas inicialmente na solução, o que nos diz que essa solução vai ter uma concentração pequena de HCl e uma concentração muito grande de H+. Assim, vemos que essa solução é muito ácida.
b. Quem confere caráter básico/alcalino a uma solução são os íons OH−. Sendo assim, quanto maior for a concentração de OH− na solução, maior será seu grau de basicidade.
Exemplo: Se eu coloco certa quantidade de NH4OH (hidróxido de amônio) em solução aquosa, ele se dissocia, liberando os íons abaixo, o que faz aumentar a concentração de OH− na solução, basificando-a. Mas ele não se dissocia totalmente, porque o sentido inverso da reação ocorre ao mesmo tempo: uma parte dos íons liberados se combinam, formando NH4OH novamente, do qual parte se dissocia, liberando íons, dos quais uma parte se combina, e assim sucessivamente, até que as concentrações de todos os compostos se mantenham constantes, como acontece com toda reação reversível.
NH4OH(aq) ⇌ NH4 +(aq) + OH−(aq)
Na solução aquosa equilibrada de NH4OH, menos de 1,5% das moléculas dessa base estão dissociadas, isto é, separadas em íons NH4 + e OH−. 1,5% se tratam da minoria das moléculas postas em solução, o que nos diz que essa solução vai ter uma concentração grande de NH4OH e uma concentração muito pequena de OH−. Assim, vemos que essa solução é pouco básica.
Disso tiramos uma conclusão importante: quanto maior for o grau de ionização de um ácido (sua capacidade de se ionizar), mais forte ele será; e quanto maior for o grau de dissociação de uma base (sua capacidade de se dissociar), mais forte ela será. Este grau de ionização ou dissociação é representado pela letra grega α e calculado da seguinte forma:
α = nº de moléculas ionizadas ou dissociadas / nº inicial moléculas
Constantes de acidez e basicidade
Em relação à constante de equilíbrio aplicada às reações envolvendo ácidos e bases, também há especificidades para as quais devemos olhar com carinho. Você se lembra da fórmula do Kc, agora Ki?
Kc = [produtos] / [reagentes]
A gente não viu que quanto maior for a concentração dos íons de um ácido ou de uma base, maior será sua força? Então, como os íons, em uma reação de ionização/dissociação, são os produtos, e as moléculas do ácido/da base os reagentes, podemos ver a força desse ácido/dessa base por meio da constante de equilíbrio também. Generalizando, temos que:
Ki = [H+][A−]/[HA]
Ka = [H+][A−]/[HA]
BOH(aq) ⇌ B+(aq) + OH−(aq)
Ki = [B+][OH−]/[BOH]
Kb = [B+][OH−]/[BOH]
Onde:
HA = ácido em solução não ionizado;
H+ = cátion hidrogênio do ácido ionizado;
A− = ânion do ácido ionizado;
BOH = base em solução não dissociada;
B+ = cátion da base dissociada;
OH− = ânion hidroxila da base dissociada;
[ ] = concentração
Conclusões importantes à beça:
Quanto maior a concentração de H+ numa solução de ácido, maior será seu Ki. Logo, quanto maior o Ki de um ácido, maior é a sua acidez. Por este motivo, substituímos o Ki por Ka: constante de acidez.
↑Ka : ↑força do ácido
Quanto maior a concentração de OH− numa solução de base, maior será seu Ki. Logo, quanto maior o Ki de uma base, maior é a sua basicidade. Por este motivo, substituímos o Ki por Kb: constante de basicidade.
↑Kb : ↑força da base
Ácidos polipróticos
Precisamos, ainda, ficar atentos à quantidade de hidrogênios ionizáveis que a molécula de um ácido possui, para determinarmos o valor de Ka. Quando o número de H ionizáveis de um ácido for maior que um, dizemos que ele é poliprótico. Recebe esse nome porque o prefixo “poli” indica “vários”, enquanto “prótico” vem de “próton”, que é uma das formas como podemos denominar o H+.
Obs: Como o elemento hidrogênio só possui 1 próton e 1 elétron em sua composição, ao perder esse único elétron e se transformar em íon H+, sua composição passa a ser somente aquele 1 próton. Por isso, em vez de íon hidrogênio, muitas vezes o chamamos de próton hidrogênio.
Tomemos como exemplo o ácido poliprótico H2S:
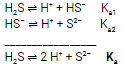
Ka = Ka1 . Ka2
Obs:
Quando o Ka de uma das etapas é muito maior que o das demais, geralmente podemos considerá-lo o Ka da reação global. É o caso do H2S, por exemplo, em que Ka1 >>> Ka2, portanto, também podemos dizer (em algumas situações/questões) que Ka = Ka1.
Na ionização de ácidos polipróticos, o ânion formado com a ionização da primeira etapa atrai mais fortemente o segundo hidrogênio que restou na sua própria molécula. Isso dificulta a sua ionização e, por conseguinte, enfraquece o ácido. Dessa forma, diz-se, em geral, que Ka1 > Ka2.
Em se tratando de n hidrogênios ionizáveis, o Ka será igual a Ka1 x Ka2 x Ka3 x … x Kan. Outros procedimentos:
Quando uma reação intermediária de KaX tiver que ser invertida para que, somada às demais, resulte na reação global, seu KaX entrará na equação do Ka global também invertido (isto é, 1/ KaX);
Quando uma reação intermediária de KaY tiver que ser multiplicada por N para que, somada às demais, resulte na reação global, seu KaY entrará na equação do Ka global elevado a N;
Quando uma reação intermediária de KaZ tiver que ser dividida por N para que, somada às demais, resulte na reação global, seu KaZ entrará na equação do Ka global com a raiz enésima (N√KaZ).
Para entender melhor, suponha que cada reação intermediária de um ácido triprótico (3 hidrogênios ionizáveis) tenha tido cada um dos comportamentos descritos acima, na ordem exposta. Neste caso, o Ka reação global será calculado assim:
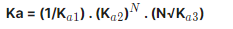
Lei da Diluição de Ostwald
Uma das formas de encontrarmos o Kc em equilíbrios químicos é realizando uma tabela com os dados de concentração dos compostos postos em reação no início, das concentrações que reagiram desses compostos e das concentrações finais dos mesmos, no equilíbrio, tá lembrada/o?
Pois bem, a chamada Lei da Diluição de Ostwald é uma generalização dessa tabela, resultando em duas fórmulas que nos ajudam a encontrar as constantes de acidez e basicidade de ácidos e bases com maior rapidez.
Acompanhe:
As questões geralmente dão o valor da concentração inicial do ácido ou da base posta em solução, e esse valor entra na tabela como concentração molar, a qual representamos por M;
Podemos descobrir qual foi a concentração do ácido ou da base que sofreu ionização/dissociação, por uma regra de três simples com os valores de α (valor não percentual, ou seja, valor decimal) e de M;
OPA, valor decimal?
Um número percentual pode ser escrito de maneira decimal, que vai ser o mesmo valor do percentual, porém depois de dividido por 100. Olha só uns exemplos:
Valor percentual
α = 20% = 20/100 = 0,2
α = 55% = 55/100 = 0,55
α = 0,1% = 0,1/100 = 0,001
α = 100% = 100/100 = 1
Agora, observe a regra de três:

Assim, colocamos na tabela que a concentração do composto inicial que foi ionizada é –Mα e a concentração de cada íon formado é +Mα;
Com isso, as concentrações de cada espécie dissolvida no equilíbrio serão: M–Mα para CA e Mα para C+ e A–.
CA (aq) ⇌ C+ (aq) + A– (aq)
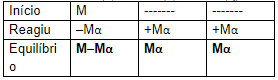
Calculando o Ki (só para não especificar se é ácido ou base, já que serve para ambos), temos:
Ki = [C+][A–]/[CA]
Ki = (Mα) . (Mα) / (M–Mα)
Ki = M2α²/M (1–α)
Ki = Mα²/1–α 🡪 Lembrando que Ki será Ka, para ácidos, e Kb, para bases.
Importante à beça:
Como o α de ácidos e bases fracos são muito baixos, tendendo a zero, o denominador da Lei de Ostwald fica: 1 – α = 1 – 0 = 1. Sendo assim, para ácidos e bases fracos, usamos a fórmula:
Ki = Mα²
- OPA, fracos?
Lembrando que classificamos ácidos/bases como fracos, moderados ou fortes, segundo seu grau de ionização, da seguinte forma:
α ≤ 5% 🡪 fracos
5% < α < 50% 🡪 moderados
α ≥ 50% 🡪 fortes
Equilíbrio iônico da água (Kw)
O cientista Friedrich Kohlrausch (1840-1910) foi o primeiro a propor que a água pura conduz eletricidade, ainda que em pequena escala. Isso ocorre porque a água se comporta de modo anfótero; isto é, em determinadas ocasiões ela age como ácido, doando prótons (H+); e em outras se comporta como base, recebendo prótons. Segundo esse raciocínio, podemos escrever a seguinte equação:
H2O(aq) + H2O(aq) ⇄ H3O+(aq) + OH-(aq)
Partindo dessa reação, podemos escrever uma expressão de Kc:

Visto que, a concentração da água permanece praticamente constante, podemos então, multiplicar ela pelo Kc e obtendo assim, uma nova constante. A constante de auto ionização da água (Kw)
Kw = [H3O+].[ OH-]
É importante perceber que essa constante a 25°C apresenta um valor de 1,0.10-14. E que esse valor é modificado dependendo da temperatura em que estamos trabalhando. Veja alguns valores de Kw para algumas temperaturas:
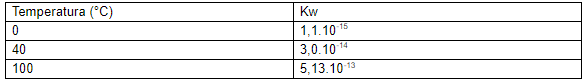
Normalmente os problemas trabalham em uma temperatura de 25°C, sendo assim, podemos chegar na seguinte relação:
Kw = [H3O+].[ OH-]
1,0.10^-14 = [H3O+].[ OH-]
[H3O+] = [ OH-] = 1,0.10^−7
Podemos afirmar então que, quando uma solução apresentar a [H3O+] = [ OH-] = 1,0.10^-7, temos então uma solução neutra. Caso [H3O+] > [ OH-], temos então uma solução ácido e quando [H3O+] < [ OH-], teremos uma solução básica. Partindo dessas relações, surge para nós o conceito de pH e pOH.
pH e pOH
pH e pOH é basicamente um artificio matemático utilizado para facilitar o trabalho nesse assunto. Quando a gente olhar para esse “p” em pH e pOH, precisamos sempre lembrar que ele representa o – log, ou seja:
pH = - log [H+] e pOH = - log [OH−]
Exemplo1:
Se tivermos uma solução que apresenta um pH = 3, podemos afirmar que:
pH = 3 --> - log [H+] = 3 --> [H+] = 10^−3
Exemplo2:
Se tivermos uma solução que apresenta uma concentração de H^++ igual a 1,0.10^−12, podemos afirmar que:
[H+] = 1,0.10^−12 --> pH = - log [H+] --> pH = - log 1,0.10^−12 --> pH = 12
OBS: O mesmo raciocínio utilizado nos exemplos para [H+] e pH, valem para [OH−] e pOH.
Outro ponto muito importante de pH e pOH, é o fato de eles serem capazes de dizer se uma solução apresenta um caráter ácido, básico ou neutro.
Surge então duas escalas, escala de pH e escala de pOH
Analisando a escala de pH, caso o pH seja menor que 7, essa solução será ácido, quando for igual a 7, será neutro e caso seja maior que 7, será básica.
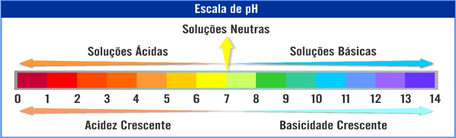
Importante!!!
Quanto menor o pH, maior a acidez. E quando maior o pH, maior a basicidade
Analisando a escala de pOH, caso o pOH seja menor que 7, a solução será básica, quando for igual a 7, será neutro e caso seja maior será ácida.
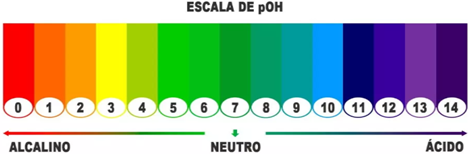
Importante!!!
Quanto menor o pOH, maior a basicidade. E quando maior o pOH, maior a acidez.
Relação entre pH e pOH
Nós vimos que, a 25 °C, Kw = 1,0.10^−14, ou seja, trazendo para a escala de pH ou pOH, os maiores valores para essa escala é 14 e o menor 0, portanto, em água a 25 °C:
pH + pOH = 14
Isso permite que, caso a gente possua o pH de uma solução, é só realizar essa simples conta e iremos obter o valor de pOH para essa solução.
Exemplo:
Para uma solução cujo pH = 5, o pOH é dado por:
pH + pOH = 14
5 + pOH = 14
pOH = 9
O mesmo é valido caso seja fornecido o valor de pOH.