Apresentação - Famílias e períodos
Divisão da tabela - Metais - Ametais e Gases nobres
Localização x Distribuição eletrônica
Propriedades periódicas (raio atômico e Energia de ionização)
Propriedades periódicas (Afinidade eletrônica e Eletronegatividade)
Exercício sobre a Divisão da tabela
Exercício sobre famílias e períodos na tabela
Tabela periódica
A Tabela Periódica dos elementos químicos, está organizada em função dos números atômicos dos elementos químicos, suas propriedades e características.
Os elementos na Tabela Periódica estão em ordem crescente de seus números atômicos e podem ser classificados como:
Metais: Na temperatura de 25 °C e pressão de 1 atm eles são sólidos, com exceção do mercúrio (Hg), que é líquido. São bons condutores de calor e eletricidade e possuem brilho, maleabilidade (capacidade de ser moldado) e ductilidade (capacidade de formar fios).
Não metais ou Ametais: Apresentam características opostas às dos metais, pois não são bons condutores de calor e eletricidade e não possuem brilho, com exceção do iodo.
Gases Nobres: São gasosos na temperatura ambiente e encontrados na natureza em sua forma isolada por serem estáveis; a nível médio não formam compostos com outros elementos espontaneamente.
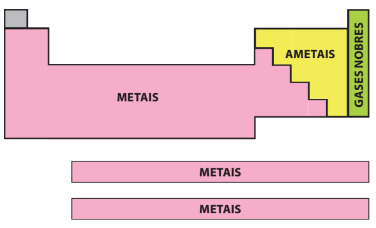
Tabela periódica de classificação dos elementos
Existem outras classificações para os elementos, eles são divididos em períodos e famílias.
Períodos → Linhas horizontais da tabela, no total são sete. Em termos de distribuição eletrônica, o período refere-se às quantidades de camadas de um átomo eletricamente neutro (estado fundamental) possui.
Exemplo:
Be – Situado no segundo periodo, possui duas camadas, K e L.
Cs – Situado no sexto periodo, possui seis camadas, K, L, M, N, O e P.
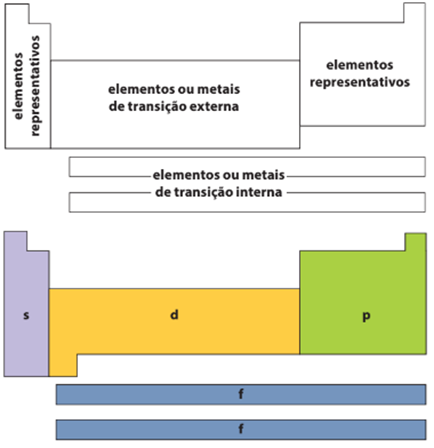
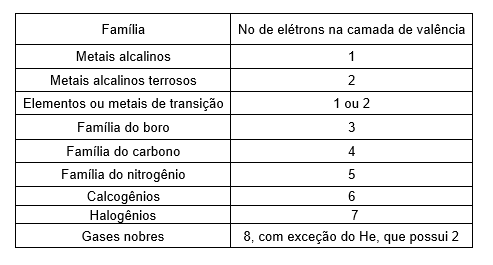
Grupo ou famílias → Linhas verticais da tabela, no total são dezoito. Atualmente os grupos são identificados pelos números de 1 a 18, contudo, há uma maneira mais antiga e ainda usual: divisão em sub-grupos ou famílias. Elementos representativos e de transição
Nos elementos representativos, ou seja, os grupos 1, 2 e de 13 a 18, o elétron mais energético está no subnível s ou p. Já os elementos de transição podem ser divididos em dois grupos distintos: os de transição externa, estando o seu elétron de maior energia no subnível d (se encontram no centro da tabela periódica), e os de transição interna, com o seu elétron de maior energia no subnível f (Se encontram nas duas linhas, que geralmente, estão no inferior de cada tabela).
Nomenclatura das famílias
Grupo 1 (1A) → Metais alcalinos
Grupo 2 (2A) →Metais alcalinos terrosos
Grupos 3 ao 12 (3B ao 2B)→ Elementos ou metais de transição
Grupo 13 (3A) →Família do boro
Grupo 14 (4A) → Família do carbono
Grupo 15 (5A) →Família do nitrogênio
Grupo 16 (6A) →Calcogênios
Grupo 17 (7A) →Halogênios
Grupo 18 ou 0 (8A) →Gases nobres
Atenção!
Vale lembrar que o Hidrogênio não pertence a família 1, mesmo estando na primeira coluna.
O hidrogênio não possui família.
Distribuição eletrônica
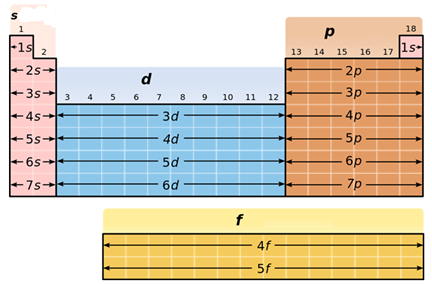
Para facilitar a distribuição eletrônica, um diagrama prático de distribuição eletrônica foi proposto. Nele, os elétrons são distribuídos em ordem crescente de energia em níveis e subníveis na eletrosfera do átomo. Veja o Diagrama de Pauling de subníveis de energia, na figura abaixo, e perceba a ordem de preenchimento expressa nas setas vermelhas.
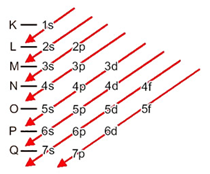
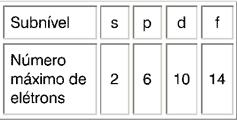
Neste ponto, é importante notar que os elétrons que existem hoje, com exceção dos descobertos em 2016, se distribuem em até 7 níveis de energia e cada nível contém um determinado número de subníveis. Além disso, todo átomo tem um certo número de elétrons* que devem ser preenchidos seguindo o Diagrama de Pauling.
O subnível s comporta o máximo de 2 elétrons; o p, 6; o d, 10 e o f, 14.
Veja o preenchimento de um átomo de Bário que possui 56 elétrons como exemplo:
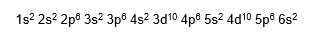
O preenchemento da eletrosfera pelos elétrons em subníveis obedece à ordem crescente de energia definida pelo diagrama de Pauling. Sendo assim, no exemplo acima, o subnível mais energético é o 6s2.
Atenção!
O elétron de diferenciador é o ultimo elétron a entrar no subnivel mais energetico. No Bário o elétron diferenciador é o segundo elétron do subnível 6s2.
*Para saber o número de elétrons a preencher em um átomo neutro lembre-se que o número de prótons é igual ao número de elétrons em um átomo neutro. Portanto, o número atômico indicará o número de elétrons. No caso de íons, deve-se adicionar ou remover elétrons à quantidade de elétrons no átomo neutro, mas todo muito cuidado, alguns podem gerar pequenas confusões.
Íons podem seguir a seguinte regra de distribuição: faz-se o preenchimento do átomo em seu estado neutro e, depois, retira(m)-se o(s) elétron(s) da camada de valência (a mais externa). No caso de ânions, adicionam-se os elétrons nas camadas seguintes.
Exemplo:

Distribuição por camadas e por subníveis
Camadas serão representadas por letras ou números (de 1 a 7 ou de K a Q) e suportam um número definido de elétrons (representadas abaixo):
Camada 1 ou K = 2;
Camada 2 ou L = 8;
Camada 3 ou M = 18;
Camada 4 ou N = 32;
Camada 5 ou O = 32;
Camada 6 ou P = 18;
Camada 7 ou Q = 8.
Perceba a diferença entre os tipos de preenchimento pelo exemplo do enxofre (S). Em uma das distribuições, mostram-se os subníveis, enquanto a outra mostra apenas as camadas preenchidas.
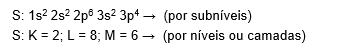
A camada de valência é o nível mais afastado do núcleo e que corresponde sempre ao maior valor em suas camadas e não necessariamente é a última da sequência, mas sim aquela que se encontra na camada mais externa, no caso do Enxofre(S) acima, é o 3s4, portanto, camada 3 ou M e no Fe2+ é o 4s2 portanto, camada 4 ou N.
Configuração eletrônica dos elementos na tabela periódica
Propriedades periódicas
Propriedade periódicas são aquelas que de acordo com o aumento do número atômico os valores aumentam ou diminuem de forma regular ao longo dos períodos e grupos da tabela periódica.
Raio atômico
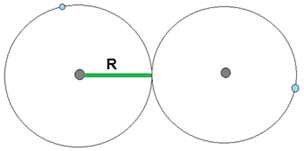
O raio atômico também pode ser chamado de tamanho do átomo, é a metade da distância entre o núcleo de dois átomos isótopos. Com isso pode-se dizer que o raio atômico é a distância do núcleo até o seu elétron mais externo.
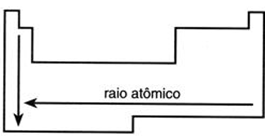
Analisando a tabela periódica podemos dizer que o tamanho do raio atômico cresce com o aumento do número de camadas (crescendo para baixo) e com a diminuição do seu número atômico (crescendo para a esquerda).
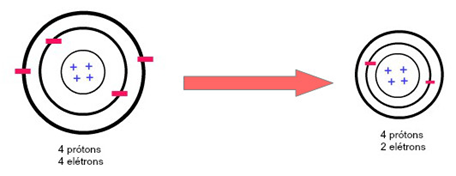
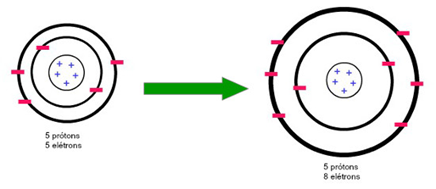
Obs.: o raio de um cátion é menor que o raio de seu átomo, no nosso exemplo abaixo é possível visualizar isto por conta da redução do número de camadas eletrônicas.
O raio de um ânion é maior que o raio de seu átomo, pois há mais elétrons se repelindo, necessitando um maior espaçamento entre eles.
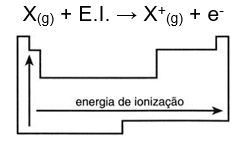
Energia de Ionização ou Potencial de ionização (E.I.)
É a energia mínima necessária para que um átomo isolado, e no estado gasoso, perca um elétron e se transforme em um cátion.
Analisando a tabela periódica podemos dizer que a energia de ionização cresce com a diminuição do número de camadas, pois haverá assim uma menor distância e maior atração entre prótons e elétrons (crescendo para cima) e com o aumento do seu número atômico (crescendo para a direita).
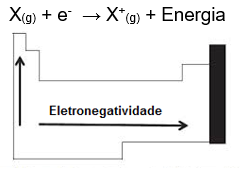
Eletronegatividade
É a energia necessária para a entrada de um elétron num átomo isolado. Quanto maior a afinidade eletrônica, maior é a capacidade do átomo de receber elétron.
Analisando a tabela periódica podemos dizer que a eletronegatividade cresce com a diminuição do período, pois haverá assim uma menor distância e maior atração entre prótons e elétrons (crescendo para cima) e com o aumento do seu número atômico (crescendo para a direita).
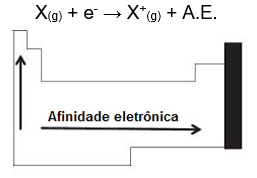
Afinidade eletrônica ou eletroafinidade (A.E.)
É a quantidade de energia liberada quando um átomo isolado, e no estado gasoso, ganha um elétron e se transforme em um ânion.
Analisando a tabela periódica podemos dizer que a afinidade eletrônica cresce com a diminuição do período, pois haverá assim uma menor distância e maior atração entre prótons e elétrons (crescendo para cima) e com o aumento do seu número atômico (crescendo para a direita).