As reações químicas são o processo que transforma as substâncias em nosso universo, moldando os elementos e compostos que nos cercam. Desde as reações complexas que ocorrem em sistemas biológicos até as transformações em escala industrial . Por isso, elas desempenham um papel fundamental em todos os aspectos da nossa vida.
Esse é um tema muito comum na prova de química do Enem e de diversos vestibulares por isso, separamos uma lista com exercícios de reações químicas para que você possa treinar os seus conhecimentos.
Resolva as questões e ao final confira o gabarito. Bons estudos!
Exercícios de reações químicas
Questão 1
(FURRN) No filme fotográfico, quando exposto à luz,ocorre a reação:2 AgBr →2 Ag + Br~2~
Essa reação pode ser classificada como:
a) pirólise.b) eletrólise.c) fotólise.d) síntese.e) simples troca.
Veja também o post sobre como ocorrem as reações químicasQuestão 2
O consumo de ácido sulfúrico pode ser utilizado como um indicador do desenvolvimento de um país. Industrialmente, esse ácido pode ser obtido a partir da pirita de ferro, que consiste basicamente em sulfeto ferroso (FeS). Classifique as equações de obtenção industrial do ácido sulfúrico mostradas a seguir:I.FeS + O~2~→ Fe + SO~2~II. 2 SO~2~+ 2 O~2~→ 2 SO~3~III. SO~3~ + H~2~O → H~2~SO~4~
a) Dupla troca, síntese, síntese.b) Dupla troca, análise, análise.c) Síntese, simples troca, dupla troca.d) Simples troca, análise, análise.e) Simples troca, síntese, síntese.
Questão 3
Fazendo-se a classificação das reações abaixo:(I) CuSO~4~ + 2NaOH → Cu(OH)~2~ + Na~2~SO~4~(II) Cu(OH)~2~ → CuO + H~2~O(III) Zn + 2AgNBaCO~3~ → 2Ag + Zn(NBaCO~3~)~2~(IV) NH~3~ + HCl → NH~4~Cl
A ordem correta é:
a) Decomposição, simples troca, dupla troca, adição.b) Dupla troca, adição, simples troca, análise.c) Dupla troca, análise, deslocamento, síntese.d) Deslocamento, análise, dupla troca, adição.e) Dupla troca, decomposição, síntese, simples troca.
Questão 4(ENEM 2022) A nanotecnologia é responsável pelo aprimoramento de diversos materiais, incluindo os que são impactados com a presença de poluentes e da umidade na atmosfera, causadores de corrosão. O processo de corrosão é espontâneo e provoca a deterioração de metais como o ferro, que, em presença de oxigênio e água, sofre oxidação, conforme ilustra a equação química:
4 Fe(s) + 2 H2O(l) + 3 O2(g) → 2 Fe2O3 ∙ H2O(s)
Uma forma de garantir a durabilidade da estrutura metálica e a sua resistência à umidade consiste na deposição de filmes finos nanocerâmicos à base de zircônia (ZrO2) e alumina (Aℓ2O3) sobre a superfície do objeto que se deseja proteger.
CLEMENTE, G. A. B. F. et al. O uso de materiais híbridos ou nanocompósitos como revestimentos anticorrosivos do aço. Química Nova, n. 9, 2021 (adaptado).
Essa nanotecnologia aplicada na proteção contra a corrosão se baseia no(a):
a) proteção catódica, que utiliza um metal fortemente redutor.
b) uso de metais de sacrifício, que se oxidam no lugar do ferro.
c) passivação do ferro, que fica revestido pelo seu próprio óxido.
d) efeito de barreira, que impede o contato com o agente oxidante.
e) galvanização, que usa outros metais de menor potencial de redução.
Questão 5
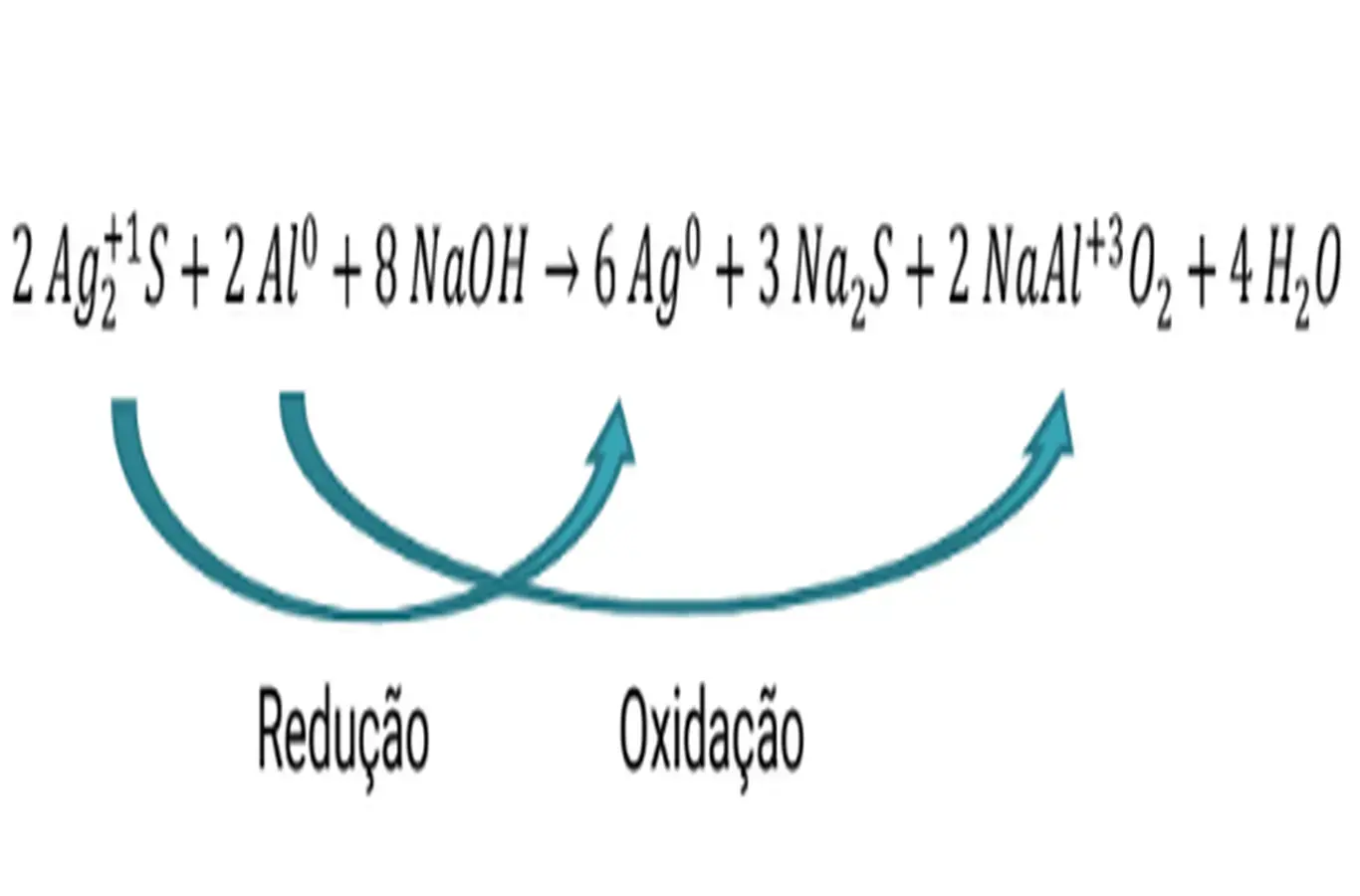
(Enem 2020) Os objetos de prata tendem a escurecer com o tempo, em contato com compostos de enxofre, por causa da formação de uma película superficial de sulfeto de prata (Ag2S), que é escuro. Um método muito simples para restaurar a superfície original desses objetos é mergulhá-los em uma solução diluída aquecida de hidróxido de sódio (NaOH), contida em uma panela comum de alumínio. A equação química que ilustra esse processo é:
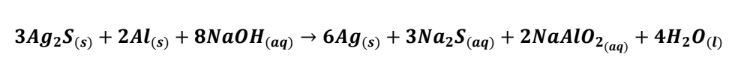
A restauração do objeto de prata ocorre por causa do(a):
a)prata, que reduz o enxofre;
b)íon sulfeto, que sofre oxidação;
c)íon hidróxido, que atua como agente oxidante;
d)alumínio, que atua como agente redutor no processo;
e)variação do pH do meio reacional, que aumenta durante a reação.
Questão 6
Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:Mg(s) + 2 H2O(ℓ) → Mg(OH)2(s) + H2(g) + 350 kJ
O aquecimento dentro da bolsa ocorre por causa da:
a) redução sofrida pelo oxigênio, que é uma reação exotérmica;
b) oxidação sofrida pelo magnésio, que é uma reação exotérmica;
c) redução sofrida pelo magnésio, que é uma reação endotérmica;
d)oxidação sofrida pelo hidrogênio, que é uma reação exotérmica;
e) oxidação sofrida pelo hidrogênio, que é uma reação endotérmica.
Questão 7:
(UERJ – 2013) Substâncias que contêm um metal de transição podem ser oxidantes. Quanto maior o número de oxidação desse metal, maior o caráter oxidante da substância. Em um processo industrial no qual é necessário o uso de um agente oxidante, estão disponíveis apenas quatro substâncias: FeO, Cu2O, Cr2O3 e KMnO4.A substância que deve ser utilizada nesse processo, por apresentar maior caráter oxidante, é:
a) FeO
b)Cu2O
c) Cr2O3
d)KMnO4
e)NaHCO3
(PUC-MG) Em um laboratório, um grupo de estudantes colocou um pedaço de palha de aço em um prato cobrindo-o com água sanitária. Após 10 minutos, eles observaram, no fundo do prato, a formação de uma nova substância de cor avermelhada, cuja fórmula é Fe2O3.
A reação que originou esse composto ocorreu entre o ferro (Fe) e o hipoclorito de sódio (NaCℓO), presentes na água sanitária, e pode ser representada pela seguinte equação não balanceada:
Fe(s) + NaCℓO(aq) → Fe2O3(s) + NaCℓ(aq)
Considerando-se essas informações, é incorreto afirmar:
Questão 9:
(Fuvest SP 2015) O ácido nítrico é um importante insumo para produção de fertilizantes, explosivos e tintas. Sua produção industrial é feita pelo processo Ostwald, em três etapas que podem ser representadas pelas reações:I. 6 NH3 + 15/2 O2 → 6 NO + 9 H2O ∆H = –1378 kJ
II. 6 NO + 3 O2 → 6 NO2 ∆H = –339 kJ
III. 6 NO2 + 2 H2O → 4 HNO3 + 2 NO ∆H = –270 kJ
Os valores dos números de oxidação do átomo de nitrogênio nas espécies nitrogenadas na equação da etapa III do processo Ostwald, na ordem apresentada, são, respectivamente:
a)+4, +5 e +2.
b)+4, –5 e –2
c)+2, +3 e +1
d)–4, +5 e + 2
e)–4, +5 e –2
(FUVEST 2009) A pólvora é o explosivo mais antigo conhecido pela humanidade. Consiste na mistura de nitrato de potássio, enxofre e carvão. Na explosão, ocorre uma reação de oxirredução, formando-se sulfato de potássio, dióxido de carbono e nitrogênio molecular. Nessa transformação, o elemento que sofre maior variação de número de oxidação é o:
A fotólise é um tipo de reação de decomposição que ocorre graças à presença de luz.
2. EResolução da questão 2:I. FeS + O~2~→ Fe + SO~2~= reação de simples troca ou deslocamento (uma substância composta (FeS) reage com uma substância simples (O~2~) e produz uma nova substância simples (Fe) e uma nova substância composta (SO~2~) pelo deslocamento entre seus elementos).
II. 2 SO~2~+ 2 O~2~→ 2 SO~3~= reação de síntese ou adição (duas substâncias reagem e produzem uma única substância mais complexa).
III. SO~3~ + H~2~O → H~2~SO~4~= reação de síntese ou adição.
3.CResolução da questão 3:
(I) CuSO~4~ + 2NaOH → Cu(OH)~2~ + Na~2~SO~4~Dupla troca. é a reação onde dois compostos químicos trocam seus radicais para formar dois novos compostos.Fórmula Geral: AB + CD → AD + CB
(II) Cu(OH)~2~ → CuO + H~2~OAnálise ou decomposição. A reação onde um composto químico se quebra (decompõe) em duas ou mais substâncias. Se a decomposição requer uma fonte de calor, a mesma é chamada decomposição térmica.
Fórmula Geral: AB → A + B
(III) Zn + 2AgNBaCO~3~ → 2Ag + Zn(NBaCO~3~)~2~
Deslocamento ou simples troca. A reação onde um elemento substitui outro em um composto químico para produzir um novo composto e o elemento deslocado.
Fórmula Geral: A + BC → AC + B
Nos reagentesA = Zn0B= Ag+1C= (NBaCO~3~)-1(IV) NH~3~ + HCl → NH~4~Clsíntese ou adição. A reação onde duas ou mais substâncias se combinam diretamente para formar um novo composto químico.
Fórmula Geral: A + B → AB
4. DResolução da questão 4:
O texto diz que a proteção consiste na deposição de filmes finos nanocerâmicos à base de zircônia (ZrO2) e alumina (Al2O3) sobre a superfície do objeto. Como o material adicionado para a proteção já está na forma de óxido, a proteção é feita por uma barreira física que impede o contato do ferro metálico com o agente oxidante (gás oxigênio).5. DResolução da questão 5:
 6. B
6. BResolução da questão 6:
A reação é exotérmica pois há calor no produto. Ocorre a oxidação do magnésio, pois seu NOX varia de 0 para +2.7. DResolução da questão 7:
Quanto maior o número de oxidação desse metal, maior o caráter oxidante da substância.FeO → Fe = +2; O = -2Cu2O → Cu = +1; O = -2Cr2O3→ Cr = +3; O = -2KMnO4→ K = +1; Mn = +7; O = -2
A substância que deve ser utilizada nesse processo, por apresentar maior caráter oxidante, é o KMnO4 (Mn = +7).
8. AResolução da questão 8:
Primeiramente, deve-se calcular o nox dos elementos envolvidos.
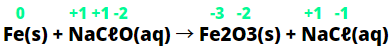
Analisando as alternativas:
a) Errada. O cloro diminuiu o Nox, ou seja, ele reduziu, por isso a substância que o contém, que é o hipoclorito de sódio, atua como agente oxidante e não como redutor.
b) Correta. O ferro oxidou-se porque seu Nox aumentou de zero para +3, indicando que ele perdeu elétrons para o cloro.
c) Correta. Veja o balanceamento abaixo:
2 Fe(s) + 3 NaCℓO(aq) → 1 Fe2O3(s) + 3 NaCℓ(aq)d) O Nox do cloro do hipoclorito diminuiu de +1 para -1, o que dá uma diferença de 2 elétrons.
9.AResolução da questão 9:
+4 -2 _________________ +1 +5 -2 ______ +2 -2 🡨 NOX6 NO2 + 2 H2O → 4 HNO3 + 2 NO ∆H = –270 kJ10. BResolução da questão 10:

Note que o elemento que sofre MAIOR variação de nox é o enxofre, partindo de 0 para +6.
Veja também o vídeo do nosso canal sobre reações químicasGostou da nossa lista de exercícios sobre reações químicas? aproveite para fazer questões antigas de provas do Enem e melhore sua preparação!
E se você estiver procurando um curso preparatório para o Enem, confirma o cursinho da Descomplica!