Leia o resumo "Quais as definições de mistura e solubilidade?" e resolva os exercícios abaixo.
1.A tabela a seguir fornece os valores de solubilidade do cloreto de sódio e do hidróxido de sódio, em água, a diferentes temperaturas.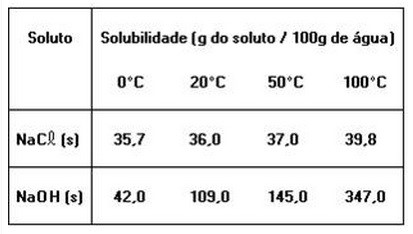
As informações anteriores e os conhecimentos sobre soluções permitem concluir:01 - Soluções são misturar homogêneas02 - Solução saturada é uma mistura heterogênea04 - O hidróxido de sódio é mais solúvel em água do que o cloreto de sódio08 - Soluções concentradas são soluções saturadas16 - Quando se separa o soluto do solvente, obtêm-se substâncias diferentes daquelas que foram inicialmente misturadas.32 - Adicionando-se 145 g de hidróxido de sódio a 100 g de água, a 20º C, obtém-se um sistema bifásico, que, após aquecido a temperaturas acima de 50º C, apresenta-se monofásico.
Soma = ?
2. O gráfico apresenta a curva de solubilidade de um sal Ax2.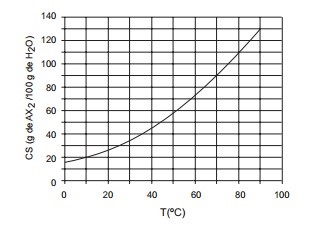
Quando uma solução aquosa saturada de Ax2, a 70º C contendo 50 g de água é resfriada para 10º C, quais são, em gramas, a massa de sal cristalizada e a massa que permanece em solução?a) 25 e 20b) 30 e 15c) 35 e 10d) 35 e 15e) 40 e 10
3. Seis soluções aquosas de nitrato de sódio, NaNO3, numeradas de I a VI, foram preparadas, em diferentes temperaturas, dissolvendo-se diferentes massas de NaNO3 em 100 g de água. Em alguns casos, o NaNO3 não se dissolveu completamente. Este gráfico representa a curva de solubilidade de NaNO3, em função da temperatura, e seis pontos, que correspondem aos sistemas preparados: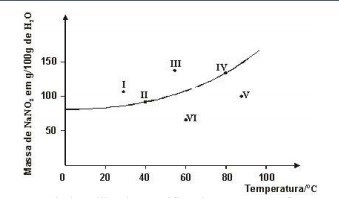
A partir da análise desse gráfico, identifique os dois sistemas em que há precipitado:a) I e IIb) I e IIIc) IV e Vd) V e VI
4.Um professor realizou várias experiências (a 20°C e 1 atm) e organizou a seguinte tabela: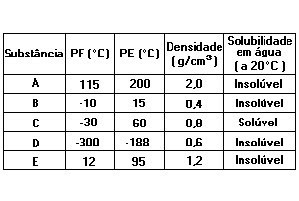 De acordo com a tabela, assinale a afirmativa INCORRETA:a) O estado físico da substância D, à temperatura ambiente, é gasoso.b) Se misturarmos a substância B com a substância D, à temperatura ambiente, forma-se uma mistura homogênea.c) A substância mais volátil, à temperatura ambiente, é a A.d) Se misturarmos as substâncias A, C e água, forma-se um sistema difásico.e) O processo mais adequado para separarmos uma mistura da substância C com a água, à temperatura ambiente, é destilação simples.
De acordo com a tabela, assinale a afirmativa INCORRETA:a) O estado físico da substância D, à temperatura ambiente, é gasoso.b) Se misturarmos a substância B com a substância D, à temperatura ambiente, forma-se uma mistura homogênea.c) A substância mais volátil, à temperatura ambiente, é a A.d) Se misturarmos as substâncias A, C e água, forma-se um sistema difásico.e) O processo mais adequado para separarmos uma mistura da substância C com a água, à temperatura ambiente, é destilação simples.
5. Os sistemas seguintes devem ser classificados como:
1) sistema polifásico e mistura heterogênea2) sistema polifásico e espécie química simples3) sistema polifásico e espécie química composta4) sistema monofásico e mistura homogênea5) sistema monofásico e espécie química simples6) sistema monofásico e espécie química composta
( ) gelo fundente( ) álcool a 96º GL( ) ar atmosférico (isento de poeira)( ) ferro durante a fusão( ) granito( ) oxigênio parcialmente liqüefeito( ) propano (C3H8)( ) ozônio
A ordem das lacunas, de cima para baixo, é:a) 3 - 4 - 6 - 2 - 1 - 2 - 6 - 5b) 3 - 4 - 4 - 2 - 1 - 2 - 6 - 5c) 1 - 4 - 4 - 1 - 1 - 2 - 6 - 5d) 3 - 4 - 4 - 1 - 2 - 6 - 5 - 5e) 4 - 3 - 2 - 6 - 1 - 5 - 2 – 5
Gabarito1. Soma = 37Resolução passo-a-passo:
01 - VERDADE, soluções são sempre misturas homogêneas02 - FALSO, não necessariamente, só será heterogênea e saturada se apresentar corpo de fundo, e isso pode não acontecer.04 - FALSO, quanto maior a quantidade de soluto/g de água em que é dissolvido, maior a solubilidade da substância.08 - FALSO, a concentração de uma solução depende da quantidade de soluto que tenho dissolvida em uma determinada quantidade de solvente. Soluções concentradas NÃO são necessariamente saturadas, pois posso ter soluções com grande quantidade de soluto, mas que eu consigo dissolver ainda mais um pouco de soluto, portanto ainda não estão saturadas.16 - FALSO, o que for colocado no recipiente será retirado, não surgirá uma nova substância ao simplesmente separá-los.32 - VERDADE, ao adicionarmos 145 g a 20º C, teremos uma solução saturada com corpo de fundo (bifásico), mas ao aquecermos a 50º C teremos uma solução saturada, que é monofásico.
2. CResolução passo-a-passo:
90 g de Ax2 ----- 100 g de água
x -------------- 50 g de águax = 45 g de Ax2 a 70º C
20 ------100 g de água
x ----------- 50 g de águax = 10 g a 10º C
A massa que vai permanecer em solução é aquela que tem que a capacidade de se dissolver a 10º C, ou seja, a massa que permanece em solução é 10 g. Então, o restante é precipitado: 35 g.
3. B
Resolução passo-a-passo:Podemos perceber que há uma linha nesse gráfico. Os pontos que estão ACIMA da linha simbolizam que as soluções são saturadas. Soluções ABAIXO da linha, simbolizam que elas são insaturadas, e soluções ACIMA da linha, simbolizam que elas são supersaturadas, ou saturadas com corpo de fundo.
Portanto, os pontos que estão acima da linha são: I e III.
4. CResolução passo-a-passo:
a) Correta. O estado físico da substância D, à temperatura ambiente, é gasoso. Como seu ponto de ebulição é -188 ºC, quando estamos na temperatura ambiente, já passamos bastante do ponto de ebulição, assim esta substância se apresenta no estado gasoso.b) Correta. Se misturarmos a substância B com a substância D, à temperatura ambiente, forma-se uma mistura homogênea.Pois, as substâncias B e D estão no estado gasoso.c) Incorreta. A substância mais volátil, à temperatura ambiente, é a A. A substância mais volátil é a que apresenta o menor ponto de ebulição, sendo esta a substância D e não a A. Na verdade a substância A é a menos volátil, mais difícil ir para o estado gasoso.d) Correta.Se misturarmos as substâncias A, C e água, forma-se um sistema difásico. A substância A é insolúvel em água, enquanto a substância C é solúvel. Então, ao adicionarmos água formaremos um sistema difásico.e) Correta. O processo mais adequado para separarmos uma mistura da substância C com a água, à temperatura ambiente, é destilação simples. Como a substância C é solúvel em água e apresenta um ponto de ebulição bem distânte do P.E da água, que são respectivamente, 60ºC e 100ºC, podemos separar a mistura por destilação simples.
5. BResolução passo-a-passo:1. gelo fundente - sistema polifásico e espécie química compostaA água é uma substância composta e ao fundir por uns instantes terá água líquida e sólida.
2. álcool a 96º GL - sistema monofásico e mistura homogêneaO álcool e a água formam uma mistura azeotrópica, apresentando 1 fase.
3. ar atmosférico (isento de poeira) - sistema monofásico e mistura homogêneaO ar é uma mistura de apenas 1 fase (incolor).
4. ferro durante a fusão - sistema polifásico e espécie química simplesO ferro, substância simples, ao fundir por uns instantes terá uma fase líquida e uma sólida.
5. granito - sistema polifásico e mistura heterogêneaO granito apresenta várias fases e é a mistura de diversos minerais.
6. oxigênio parcialmente liqüefeito - sistema polifásico e espécie química simplesO oxigênio é uma substância simples e ao liquefazer por uns instantes terá uma fase líquida e uma gasosa.
7. propano (C3H8) - sistema monofásico e espécie química compostaToda substância pura é uma solução e monofásica. O propano é uma substância composta, apresenta 2 tipos de elementos químicos, o carbono e o hidrogênio.
8. ozônio - sistema monofásico e espécie química simplesToda substância pura é uma solução e monofásica. O ozônio é uma substância simples, apresenta apenas um único tipo de elemento químico, o oxigênio. Ozônio (O3).
