Preparado para resolver uma série de exercícios sobre Funções Inorgânicas? Treine o seu conhecimento e prepare-se para gabaritar o ENEM e vestibulares! Vamos lá?

Leia o resumo "O que caracteriza as funções inorgânicas?" e resolva os exercícios abaixo.
1. (VUNESP-SP) Sobre o ácido fosfórico, são feitas cinco afirmações seguintes:
 I) Tem forma molecular H3PO4 e fórmula estruturalII) É um ácido triprótico cuja molécula libera três íons H+ em água.III) Os três hidrogênios podem substituídos por grupos orgânicos formando ésteres.IV) É um ácido tóxico que libera, quando aquecido, PH3 gasoso de odor irritante.V) Reage com bases para formar sais chamados fosfatos.
I) Tem forma molecular H3PO4 e fórmula estruturalII) É um ácido triprótico cuja molécula libera três íons H+ em água.III) Os três hidrogênios podem substituídos por grupos orgânicos formando ésteres.IV) É um ácido tóxico que libera, quando aquecido, PH3 gasoso de odor irritante.V) Reage com bases para formar sais chamados fosfatos.Dessas afirmações, estão correta:a) I e II, somente.b) II, III, IV, somente.c) I e V, somente.d) III e V, somente.e) I, II, III e V, somente.
2. No processo de produção de sal refinado, a lavagem do sal marinho provoca a perda do iodo natural, sendo necessário, depois, acrescenta-lo na forma de iodeto de potássio. Outra perda significativa é a de íons magnésio, presentes no sal marinho na forma de cloreto de magnésio e sulfato de magnésio. Durante este processo são também adicionados alvejantes, como o carbonato de sódio. As fórmulas representativas das substâncias destacadas no texto anterior são, respectivamente:
a) KI, MgCl, MgSO4 e NaCO3b) K2I, MgCl2, Mg2SO4 e Na2CO3c) K2I, Mg2Cl, MgSO4 e Na(CO3)2d) KI, MgCl2, MgSO4 e Na2CO3e) KI2, Mg2Cl, Mg(SO4)2 e Na3CO3
3. Associe corretamente, de cima para baixo, os itens a seguir:
I- sal básico. Mg(OH)Cl (I)II- sal duplo. NaKSO4 (II)III - sal ácido. NaHCO3 (III)IV - sal hidratado. Na2B4O7. 10 H2O (IV)
A associação correta é:a) I, III, IV, II.b) II, IV, III, I.c) I, II, III, IV.d) II, III, IV, I.e) IV, I, II, III.
4. Relacione as colunas, apresentando o sal que está presente em cada um dos produtos utilizados no cotidiano.
a) Cloreto de sódio – NaCl ( ) Mármoreb) Carbonato de cálcio – Na2CO3 ( ) Água sanitáriac) Hipoclorito de Sódio – NaClO ( ) Sal de cozinhad) Carbonato de cálcio – CaCO3 ( ) Soda
5. (Unifor-CE) Os íons Ca2+, ClO- e Cl- compõem o sal de fórmula:
a) Ca(ClO)Clb) Ca(ClO)Cl2c) Ca(ClO)2Cld) Ca2(ClO)2Cle) Ca(ClO)2Cl2
6. (Mackenzie/SP)
N2O5 + H2O → 2 HNO3
CO + H2O → não reage
K2O + H2O→2 KOH
Nas equações acima, do comportamento mostrado pelos óxidos conclui-se que:
a) K2O é um peróxidob) CO é um óxido neutro ou indiferentec) K2O é um óxido ácidod) N2O5 é um óxido duplo ou mistoe) N2O5 é um óxido básico
7. (UFMG 1ª Fase 2009) Considere certa quantidade de água e suco de limão, misturados, contida em um copo.
Analise estas três afirmativas concernentes a esse sistema:
I. O sistema é ácido.II. O pH do sistema é maior que 7.III. No sistema, a concentração dos íons H+ é maior que a dos OH–.A partir dessa análise, é CORRETO afirmar que
a) apenas as afirmativas I e II estão certas.b) apenas as afirmativas I e III estão certas.c) apenas as afirmativas II e III estão certas.d) as três afirmativas estão certas.
8. A experiência a seguir é largamente utilizada para diferenciar soluções eletrolíticas de soluções não eletrolíticas. O teste está baseado na condutividade elétrica e tem como consequência o acendimento da lâmpada.
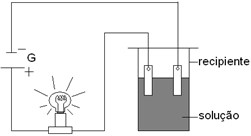
A lâmpada acenderá quando no recipiente estiver presente a seguinte solução:
a) O2(g)b) H2O(g)c) HCℓ(aq)d) C6H12O6(aq)
9. Quantidades adequadas de hidróxido de magnésio podem ser usadas para diminuir a acidez estomacal. Qual o ácido, presente no estômago, principal responsável pelo baixo pH do suco gástrico? Escreva a equação da reação entre esse ácido e o hidróxido de magnésio.Observe que ocorre uma neutralização dos íons H+ (ou H3O+) do ácido pelos íons OH- da base, diminuindo portanto, a acidez estomacal: H+ + OH- → H2O
a) O ácido presente no estômago é o ácido clorídrico (HCl).4HCl + Mg(OH)2 → MgCl3 + 2H2O ou 2H+(aq) + Mg(OH)4(s) → Mg++ (aq) = 2H2Ob) O ácido presente no estômago é o ácido clorídrico (HCl).2HCl + Mg(OH)2 → MgCl2 + 2H2O ou 3H+(aq) + Mg(OH)2(s)→ Mg++ (aq) = 4H2Oc) O ácido presente no estômago é o ácido clorídrico (HCl).2HCl + Mg(OH)2 → MgCl4 + 2H2O ou 2H+(aq) + Mg(OH)3(s) → Mg++ (aq) = 2H5Od) O ácido presente no estômago é o ácido clorídrico (HCl).2HCl + Mg(OH)2 → MgCl2 + 2H2O ou 2H+(aq) + Mg(OH)2(s) → Mg++ (aq) = 2H2O
10. Considere soluções aquosas de nitrato de sódio (NaNO3), nitrato de chumbo (Pb(NO3)2) e cloreto de potássio (KCl).
NaNO3 + Pb(NO3)2 - não há precipitaçãoNaNO3 + KCl - não há precipitaçãoPb(NO3)2 + KCl - forma-se precipitadoI) Escreva a equação da reação de precipitação.II) Qual substância constitui o precipitado? Justifique sua resposta, baseando-se nas informações acima.
a) I) Equação da reação de precipitado: Pb(NO3)2 + 2 KCl → PbCl2 + 2 KNO3II) O cloreto de chumbo II (PbCl2) é insolúvel e constitui o precipitado. O nitrato de potássio é solúvel e fica em solução aquosa.b) I) Equação da reação de precipitado: Pb(NO4)2 + KCl → PbCl3 + 2 KNO3II) O cloreto de chumbo II (PbCl4) é insolúvel e constitui o precipitado. O nitrato de potássio é solúvel e fica em solução aquosa.c) I) Equação da reação de precipitado: Pb(NO3)3 + KCl → PbCl2 + 2 KNO4II) O cloreto de chumbo II (PbCl2) é solúvel e constitui o precipitado. O nitrato de potássio é solúvel e fica em solução aquosa.d) I) Equação da reação de precipitado: Pb(NO3)4 + KCl → PbCl2 + 3 KNO2II) O cloreto de chumbo II (PbCl2) é solúvel e constitui o precipitado. O nitrato de potássio é insolúvel e fica em solução aquosa.
GABARITO1. EResolução passo-a-passo:
I) CERTA. O ácido fosfórico tem como fórmula o H3PO4. Este ácido apresenta como átomo central o fósforo, sendo este da família 5A, quando apresenta nox +5 e este sendo o maior nox o nome do ácido recebe o sufixo ico. Então,
H3+1PO4-2 =
+3 + X -8 = +5
III) CERTA.Os três hidrogênios ácidos podem ser convertidos por substituição gradual a fosfatos primários, secundários e terciários, que podem reagir formando ésteres.
IV) ERRADA. Não libera, quando aquecido, PH3 gasoso de odor irritante.
V) CERTA. Reage com bases para formar sais chamados fosfatos.Um ácido mais uma base gera sal e água, e esses sais são chamados de fosfatos, por apresentarem PO4 em sua composição.
2. DResolução passo-a-passo:
Iodeto de potássioPotássio – K – família 1 – nox - +1Iodos – I – família 17 – nox -1K+1 I-1 - cruza-se as cargas à KI
Cloreto de magnésioMagnésio – Mg – família 2 – nox +2Cloro – Cl – família 17 - nox -1Mg+2 Cl-1 - cruza-se as cargas à MgCl2
Sulfato de magnésioMagnésio – Mg – família 2 – nox +2Sulfato- ânion SO4 – nox -2(O enxofre apresenta o maior nox = +6)Mg+2 SO4-2 - cruza-se as cargas à MgSO4
Carbonato de sódioSódio – Na – família 1 – nox +1Carbonato – Ânion CO3-2(O carbono apresenta o maior nox = +4)Na+1 CO3-2 - cruza-se as cargas à Na2CO3
3. CResolução passo-a-passo:
- Hidroxissal ou sal básico: Apresenta 2 ânions, onde um deles é o OH- e somente um cátion.R.: Mg(OH)Cl (I)
- Sal duplo ou misto: sal que apresenta dois cátions diferentes ou dois ânions diferentes. Exceto H+ e OH-
R.: NaKSO4 (II)
- Hidrogenossais: Apresenta 2 cátions, onde um deles é o H+ e somente um ânion.R.: NaHCO3 (III)
- Sal hidratado: Apresenta água de cristalização, ou seja, água em seu retículo cristalino.
R.: Na2B4O7. 10 H2O (IV)
4. d-c-a-bResolução passo-a-passo:
a) Cloreto de sódio – NaCl ( ) Mármoreb) Carbonato de cálcio – Na2CO3 ( ) Água sanitáriac) Hipoclorito de Sódio – NaClO ( ) Sal de cozinhad) Carbonato de cálcio – CaCO3 ( ) Soda
O mármore é principalmente formado por calcário, cuja formula é CaCO3.A água sanitária é formada por Hipoclorito de Sódio.
O nosso NaCl compõe o nosso famoso sal de cozinha.O carbonato de sódio é também conhecido como barrilha ou soda, e sua principal aplicação é na fabricação de vidro comum.
5. AResolução passo-a-passo:
Sendo o sal formado pelos íons Ca2+, ClO- e Cl-. Para formar o composto devemos formar uma molécula com carga zero. Podemos representar através do esquema abaixo.
Ca2+, ClO- e Cl-
Como temos um cátion bivalente e dois ânions monovalentes, podemos perceber que a proporção é de 1:1:1, gerando a molécula com carga zero:Ca(ClO)Cl.
6. BResolução passo-a-passo:
a) Peróxidos: reagem com água ou com ácido diluído formando água oxigenada (H2O2). No caso, o óxido K2O é um óxido básico, estes reagem com água para formar bases ou reagem com ácidos formando sal e água.
K2O + H2O → 2KOH
2K2O + 2HCl → 2KCl + H2O
b) Óxidos neutros: não reagem com água, nem com ácido e nem com base.São gases e moleculares, formados por não-metais.O CO é um exemplo deste óxido. Esta é a opção certa ;)c) Como vimos na alternativa A, o K2O é um óxido básico e não um óxido ácido.
d) Óxidos Anfóteros: comportam-se como óxidos básicos e também como óxidos ácidos. Só reagem com ácido forte ou base forte.
São, em geral, sólidos iônicos, insolúveis em água.
Podem ser formados por: Zn, Pb, Sn, As, Sb.
O N2O5, quando reage com água forma um ácido, o ácido nítrico.
N2O5 + H2O → 2 HNO3
Portanto, ele é um óxido ácido
e) Como vimos na alternativa d), o N2O5 é um óxido ácido e não um óxido básico.
7. BResolução passo-a-passo:A afirmativa I está correta. O limão apresenta características ácidas, devido a presença de substâncias como ácido cítrico, além do sabor azedo.
A afirmativa II está errada. Abaixo podemos observar uma escala de pH.
Analisando esta escala, podemos afirmar que um pH dito ácido apresenta pH menor que 7 e substâncias básicas é que apresentam pH maior que 7.
A afirmativa III está correta. A concentração dos íons H+ é maior que a dos OH–. Todo ácido libera H+ no meio, enquanto as bases liberam OH-. Então, para o meio estar ácido , a quantidade de íons H+ deve ser maior que a de íons OH-.
8. CResolução passo-a-passo:
Essa é uma solução aquosa de ácido clorídrico, isto é, cloreto de hidrogênio dissolvido em água, liberando os íons a seguir:
HCl → H3O1+ + Cl1- ou HCl → H1+ + Cl1-
Esses íons conduzem corrente elétrica. As demais substâncias são moleculares, sendo que o oxigênio e a água estão no estado gasoso, e a glicose (C6H12O6(aq)) está dissolvida na água, mas não forma íons, ela não pertence a nenhuma função inorgânica, mas é um composto inorgânico.
9. DResolução passo-a-passo:
O ácido presente no estômago é o ácido clorídrico (HCl).A equação citada envolve a reação entre o ácido clorídrico estomacal e o hidróxido de magnésio. Uma típica reação de neutralização. Forma-se como produtos sal e água.Vamos montar a reação:
H+ Cl- + Mg+2 (OH)2 -1 →
Realizando a reação de dupla troca obtemos os seguintes produtos:H+ Cl- + Mg+2 (OH)2 -1 → Mg+2 Cl- + H+(OH)2 → MgCl2 + H2O
HCl + Mg(OH)2 → MgCl2 + H2O
Mas esta reação ainda não está balanceada. Balanceando, temos:
2HCl + Mg(OH)2 → MgCl2 + 2H2O
10. AResolução passo-a-passo:
A mistura de Pb(NO3)2 e KCl forma um precipitado. Devemos montar a reação e encontrar os devidos produtos. Esta reação é de dupla troca.
Pb+2(NO3)2 –¹ + K+1 Cl–¹→ Pb+2 Cl-1 + K+1(NO3)2 -1Pb(NO3)2 + KCl → PbCl2 + KNO3
Mas esta reação ainda não está balanceada. Balanceando, temos:
Pb(NO3)2 + 2KCl → PbCl2 + 2KNO3
O cloreto de chumbo II (PbCl2) é insolúvel e constitui o precipitado. O nitrato de potássio é solúvel e fica em solução aquosa.

