Descubra tudo sobre a Teoria do Octeto aqui!
Em 1916, o cientista alemão Walther Kossel (1888-1956) observou que um átomo torna-se mais estável quando possui oito elétrons na última camada (camada de valência) ou dois elétrons quando possui apenas a camada K, fato que publicou em sua “Teoria Eletrônica da Valência”, que o americano Gilbert Newton Lewis (1875-1946) aperfeiçoou em sua teoria conhecida como “Regra do Octeto”. Vamos aprender um pouco mais sobre essa teoria?[embed]https://www.youtube.com/watch?v=sLjJLHrHzdU&feature=youtu.be[/embed]
Podemos enunciar a Teoria do Octeto assim:
“Ocorrem reações químicas em que participam elementos químicos com estrutura menos estável, porque elementos químicos com estrutura eletrônica menos estável têm tendência a adquirir estrutura mais estável por meio do ganho, da perda ou do compartilhamento de elétrons.”Assim, os átomos precisam doar ou compartilhar elétrons para adquirir sua estabilidade. Para isso, cada átomo numa ligação deve completar sua camada de valência, ou seja, sua última camada, com 8 elétrons. Sendo assim, o átomo é considerado estável quando apresentar 8 elétrons em sua última camada da eletrosfera. Com exceção do Hidrogênio e do Hélio que são estáveis com 2 elétrons na sua última camada.
Segundo a Teoria do Octeto, as moléculas ou íons tendem a ser mais estáveis quando a camada de elétrons externa de cada um dos seus átomos está preenchida com a configuração de um gás nobre (oito elétrons). Essa teoria explica porque os elementos sempre formam ligações: para atingirem a estabilidade.
Os únicos elementos que são encontrados isolados na natureza de forma estável são os gases nobres, isto é, os elementos da família 18 ou VIII A (hélio (He), neônio(Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn)).
Exemplo:
A famosa molécula da água
Formada pela ligação de dois átomos de hidrogênio com um de oxigênio. O hidrogênio possui só uma camada e um elétron no estado fundamental; portanto, segundo a regra do octeto, cada átomo de hidrogênio precisa ganhar mais um elétron para ficar estável. Já o oxigênio possui seis elétrons na camada de valência; com isso, ele precisa ganhar 1 elétron para ficar estável. Como nos dois casos é preciso ganhar elétrons, não há como um perder e outro ganhar, então eles vão compartilhar seus elétrons, estabelecendo uma ligação química.
[caption id="attachment_58619" align="aligncenter" width="300"]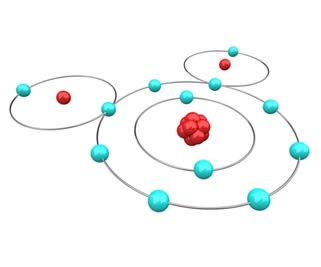 Molécula de água[/caption]
Molécula de água[/caption]
A regra do octeto não é aplicada para todos os elementos, ela explica principalmente as ligações entre os elementos representativos (famílias A). Porém, mesmo entre os elementos representativos, existem muitas exceções*. Ainda assim, a teoria do octeto continua sendo usada, porque ela explica as ligações químicas que formam a maioria das substâncias presentes na natureza.
Exercícios
1) (Mackenzie-SP) Para que átomos de enxofre e potássio adquiram configuração eletrônica igual à de um gás nobre, é necessário que:(Dados: número atômico S = 16; K = 19).a) o enxofre receba 2 elétrons e que o potássio receba 7 elétrons.b) o enxofre ceda 6 elétrons e que o potássio receba 7 elétrons.c) o enxofre ceda 2 elétrons e que o potássio ceda 1 elétron.d) o enxofre receba 6 elétrons e que o potássio ceda 1 elétron.e) o enxofre receba 2 elétrons e que o potássio ceda 1 elétron.
2) (UCBA) Considerando suas posições na Tabela Periódica, o hidrogênio e o enxofre devem formar o composto de fórmula:
a) HSb) HS2c) H2Sd) H2S3e) H3S2
3) (Integrado RJ/1996) Das espécies químicas abaixo, indique aquela que NÃO obedece à regra do octeto.
a) MgBr2b) AlCl3c) CO2d) NaCle) SO2
Gabarito
1. E2. C
3. B
