Leia o resumo "Você sabe como funciona uma Pilha?" e resolva os exercícios abaixo.
1. As pilhas e as baterias são dispositivos nos quais uma reação espontânea de oxidorredução transforma energia química em energia elétrica. Portanto, sempre há uma substância que se reduz, ganhando elétrons, que é o cátodo, e uma que se oxida, perdendo elétrons, que é o ânodo. Abaixo, temos um exemplo de uma pilha eletroquímica: A respeito dessa pilha, responda:a) Qual eletrodo, A ou B, está sofrendo redução e qual está sofrendo oxidação?b) Qual eletrodo é o cátodo e qual é o ânodo?c) Escreva a semirreação que ocorre nos eletrodos A e B e a reação global da pilha.d) concentração dos íons B3+ e A2+ aumenta ou diminui?e) Ocorre corrosão ou deposição dos eletrodos A e B? 2. (UERJ – 2010)A célula a combustível é um tipo de pilha que gera energia elétrica a partir da reação química entre os gases hidrogênio e oxigênio, como mostra o esquema:
A respeito dessa pilha, responda:a) Qual eletrodo, A ou B, está sofrendo redução e qual está sofrendo oxidação?b) Qual eletrodo é o cátodo e qual é o ânodo?c) Escreva a semirreação que ocorre nos eletrodos A e B e a reação global da pilha.d) concentração dos íons B3+ e A2+ aumenta ou diminui?e) Ocorre corrosão ou deposição dos eletrodos A e B? 2. (UERJ – 2010)A célula a combustível é um tipo de pilha que gera energia elétrica a partir da reação química entre os gases hidrogênio e oxigênio, como mostra o esquema: 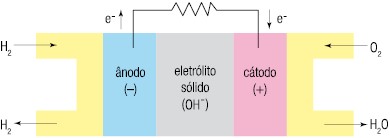 Para seu funcionamento ininterrupto, a célula precisa ser continuamente alimentada com o oxigênio do ar e com o gás hidrogênio proveniente da seguinte reação química:Considere os valores abaixo, relativos ao funcionamento da célula sob condições-padrão:
Para seu funcionamento ininterrupto, a célula precisa ser continuamente alimentada com o oxigênio do ar e com o gás hidrogênio proveniente da seguinte reação química:Considere os valores abaixo, relativos ao funcionamento da célula sob condições-padrão: Calcule a força eletromotriz, em volts, da célula a combustível e a variação de entalpia, em kJ, da reação de obtenção do hidrogênio.3. (UFPE) – Considere uma cela galvânica formada por semicelas-padrão de cobre e de zinco, cujos potenciais de redução são os seguintes:Cu2+ + 2 e- → Cu Eº = + 0,34 VZn2+ + 2 e- → Zn Eº = - 0,76 VÉ correto afirmar que:a) os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.b) o potencial-padrão da cela é – 0,42 V.c) quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.d) os íons zinco são reduzidos a zinco metálico.e) o eletrodo de cobre é o cátodo.
Calcule a força eletromotriz, em volts, da célula a combustível e a variação de entalpia, em kJ, da reação de obtenção do hidrogênio.3. (UFPE) – Considere uma cela galvânica formada por semicelas-padrão de cobre e de zinco, cujos potenciais de redução são os seguintes:Cu2+ + 2 e- → Cu Eº = + 0,34 VZn2+ + 2 e- → Zn Eº = - 0,76 VÉ correto afirmar que:a) os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.b) o potencial-padrão da cela é – 0,42 V.c) quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.d) os íons zinco são reduzidos a zinco metálico.e) o eletrodo de cobre é o cátodo. Gabarito
1. Resolução passo-a-passo:a) O eletrodo A está sofrendo redução, porque está ganhando elétrons, portanto, seu Nox (Número de Oxidação) irá diminuir. Já o eletrodo B está sofrendo oxidação, porque está perdendo elétrons e seu Nox irá aumentar.b) O eletrodo A é o cátodo e o B é o ânodo.c) Semirreação do ânodo: B(s)→ B3+(aq)+ 3 e-Semirreação do cátodo: A2+(aq) + 2 e- → A(s) Para encontrar a equação que representa a reação global dessa pilha, teremos que multiplicar a semirreação do ânodo por 2 e a do cátodo por 3, para poder igualar os elétrons que foram transferidos e recebidos nos eletrodos:Semirreação do ânodo: 2 B(s) → 2 B3+(aq) + 6 e-Semirreação do cátodo: 3 A2+(aq) + 6 e- → 3 A(s)+
Reação Global: 2 B(s) +3 A2+(aq) → 2 B3+(aq)+ 3 A(s)
d) Conforme mostra a reação global, a concentração de B3+aumenta e de A2+e) Haverá deposição sobre o eletrodo A e corrosão do eletrodo B 2. Resolução passo-a-passo:Vamos calcular a força eletromotriz da célula a combustível e a variação de entalpia da reação de obtenção de hidrogênio.As semirreações que ocorrem na célula a combustível são:Ânodo: 2 H2 (g) + 4 OH-(aq) 4 H2O() + 4 e- E° = 0,83 VCátodo: O2 (g) + 2 H2O() + 4 e- 4 OH- (aq) E° = 0,40 VA reação global e a força eletromotriz são obtidas a partir da soma dessas duas semirreações:2 H2 + O2 2 H2O E° = 1,23 VA variação de entalpia da reação de formação de hidrogênio é a diferença entre a entalpia dos produtos e a entalpia dos reagentes:∆H = Hf – Hi = HCO2 + ( 4.HH2 –HCH4 – 2.HH2O)= -394 + ( 4.0 + 75 + 2. 241) = 163kJ 3. EResolução passo-a-passo:Como o potencial de redução do cobre é maior, Cu2+ sofre redução e o Zn sofre oxidação. Assim:a) Falso. Os elétrons no circuito externo fluirão do eletrodo de zinco para o eletrodo de cobre.b) Falso. O potencial padrão da cela é +1,10 V.c) Falso. Quando o equilíbrio for atingido haverá diferença de potencial entre os eletrodos.d) Falso. O zinco sofre oxidação e, portanto, o zinco metálico é oxidado a íons Zn2+.e) Verdadeiro. Como o eletrodo de cobre possui maior potencial de redução, este será o cátodo.