A distribuição eletrônica dos elementos químicos, bem como o dos seus isótopos e seus íons é fundamental para entendermos as características desses compostos, pois muitas de suas propriedades estão diretamente relacionadas às suas distribuições eletrônicas.
Fazer uma distribuição eletrônica é definir toda a configuração da eletrosfera em estudo, determinando sua quantidade de níveis, subníveis e quantidade de elétrons em cada um desses níveis e subníveis.
Distribuição eletrônica
A distribuição eletrônica de uma determinada espécie química é realizada através do diagrama conhecido como “Diagrama de Linus Pauling”, que determina a ordem dos subníveis de energia em sequência crescente de energia.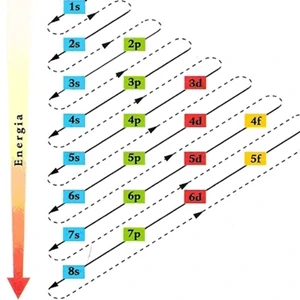
</br>
Figura 1: Ordem crescente de energia dos subníveis: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7pComo podemos ver no diagrama e na sequência acima, existem quatro subníveis de energia, conhecidos como s, p, d, e f, (macete: Sem Pão Da Fome) cada um desses subníveis comporta no máximo 2, 6, 10 e 14 elétrons, respectivamente.
Isso significa, por exemplo, que o subnível p pode conter de 1 a 6 elétrons, nunca uma quantidade superior ao seu limite.
E que todos os subníveis que pertencem ao mesmo nível de energia estão na mesma camada.
 Assista também o nosso vídeo sobre distribuição eletrônica
Assista também o nosso vídeo sobre distribuição eletrônicaComo fazer distribuição eletrônica de um átomo
Para fazermos a distribuição eletrônica de um átomo devemos distribuir a sua quantidade total de elétrons em seus subníveis de energia, respeitando o diagrama de Linus Pauling, preenchendo os subníveis de menor energia primeiro e conforme os for completando em suas quantidades máximas seguir para os subníveis seguintes e assim sucessivamente.Veja o exemplo a seguir:
Distribuição eletrônica do átomo de sódio(Na) em subníveis e níveis de energia:
Segundo a tabela periódica dos elementos químicos, o sódio é um elemento que no seu estado fundamental possui número atômico igual a 11, isso significa que no estado fundamental o sódio possui 11 elétrons em seu átomo neutro. Sendo assim sua distribuição eletrônica ficará:
- Na11: possui 11 elétrons
- Em subnível: 1s2 2s2 2p6 3s1
- Em nível: K = 2 L = 8 M = 1
- O8: possui 8 elétrons
- Em subnível: 1s2 2s2 2p4
- Em nível: K = 2 L = 6
- S16: possui 16 elétrons
- Em subnível:1s2 2s2 2p6 3s2 3p4
- Em nível: K = 2 L = 8 M = 6
Como fazer a distribuição eletrônica de íons
Um íon pode ser classificado como um cátion ou como um ânion, os cátions são átomos que perderam elétrons e os ânions átomos que ganharam elétrons. Esses elétrons perdidos e ganhos devem ser levados em consideração quando vamos fazer a distribuição eletrônica de um íon.Distribuição eletrônica em cátions
Faremos a distribuição eletrônica do seu átomo neutro e somente no final retiraremos o(s) elétron(s) perdido(s) da sua última camada. É IMPORTANTE QUE ESSA REGRA SEJA SEGUIDA. Veja os exemplos a seguir:- Na1+11: possui 11 elétrons.
- Distribuição do seu átomo neutro: 1s2 2s2 2p6 3s1
- O Na1+ possui carga 1+, isso significa que ele perdeu um elétron e que esse elétron será retirado de sua última camada, portanto, sua distribuição eletrônica será:
- Em subnível: 1s2 2s2 2p6
- Em nível: K = 2 L = 8
Vamos ver mais um exemplo?
- Fe2+26: possui 26 elétrons
- Distribuição do seu átomo neutro: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
- O Fe2+ possui carga 2+, isso significa que ele perdeu dois elétrons e que esses elétrons serão retirado de sua última camada, que nesse caso é o nível 4, portanto, sua distribuição eletrônica será:
- Em subnível: 1s2 2s2 2p6 3s2 3p6 3d6
- Em nível: K = 2 L = 8 M = 14
Distribuição eletrônica em ânions
Faremos a distribuição eletrônica somando a quantidade de elétrons do seu átomo no estado fundamental mais a quantidade de elétrons ganhos.- O82-: possui 10 elétrons, 8 no seu estado fundamental mais 2 elétrons ganhos.
- Em subnível: 1s2 2s2 2p6
- Em nível: K = 2 L = 8
- Cl17-1: possui 18 elétrons, 17 no seu estado fundamental mais 1 elétron ganho.
- Em subnível:1s2 2s2 2p6 3s2 3p6
- Em nível: K = 2 L = 8 M = 8
Distribuição eletrônica: exercícios
- Sabe-se que os elétrons de um átomo podem ser distribuídos em até níveis, nomeados pelas letras K, L, M, N, O, P, Q. Cada nível pode conter até 4 subníveis, denominados s, p, d, f. O número máximo de elétrons que o subnível f pode possuir é a) 14 b) 12 c) 10 d) 8 e) 6
- Um íon pode ser conceituado como um átomo ou grupo de átomos, com algum excesso de cargas positivas ou negativas. Nesse contexto, a distribuição eletrônica do íon Mg2+ pode ser representada corretamente por
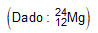
a) 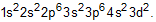 b)
b) 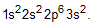 c)
c)  d)
d) 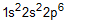 e)
e) 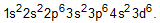
- As propriedades das substâncias químicas podem ser previstas a partir das configurações eletrônicas dos seus elementos. De posse do número atômico, pode-se fazer a distribuição eletrônica e localizar a posição de um elemento na tabela periódica, ou mesmo prever as configurações dos seus íons.
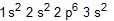 b)
b) 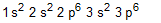 c)
c) 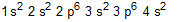 d)
d) 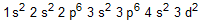 e)
e) 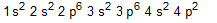
Gabarito
- A
- D
- B
Acompanhe o Gabarito do Enem 2024, que a gente divulga logo depois da prova!