O que são as Forças Intermoleculares? Como vivem, onde estão? Saiba tudo isso e muito mais nesse resumo imperdível e prepare-se para o vestibular!

Forças intermoleculares
Quando duas moléculas se aproximam, há uma interação de seus campos magnéticos, o que faz surgir uma força entre elas. É o que chamamos de força intermolecular. Essas forças variam de intensidade, dependendo do tipo da molécula (polar ou apolar) e, no caso das polares, de quão polares elas são.Elas podem ser classificadas em:
1) Dipolo permanente - Dipolo permanente
Devido a alguma distorção na distribuição da carga elétrica, um lado da molécula é ligeiramente mais "positivo" e o outro é ligeiramente mais "negativo". A tendência é que essas moléculas se alinhem e interajam umas com as outras, por atração eletrostática entre os dipolos opostos.Se a molécula da substância contém um dipolo permanente (devido à polaridade de uma ou mais de suas ligações covalentes), então podemos facilmente ver como essas moléculas se atraem umas às outras: o lado positivo do dipolo de uma molécula atrai o lado negativo do dipolo da outra molécula. Essa força existe, portanto, entre moléculas polares (μtotal ≠ 0).
2) Dipolo induzido – dipolo induzido
Essa interação ocorre entre moléculas apolares. Não possuem dipolos necessários para a interação entre as moléculas. Então como a interação ocorre?Por um certo tempo, devido à movimentação das moléculas, pode ocorrer a formação de dipolos momentâneos e assim atraem as demais moléculas. Ocorre uma polarização induzida.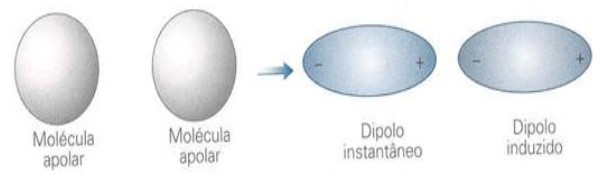
3) Ligação de hidrogênio
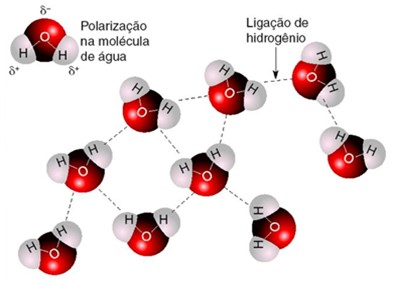
A água, portanto, deve possuir um tipo de interação diferenciado. O que acontece é que os hidrogênios ligados ao oxigênio é que formam o lado "positivo" do dipolo permanente dessa molécula. O átomo de hidrogênio é formado por apenas um próton e um elétron. Como o elétron é fortemente atraído pelo oxigênio, na água, este próton encontra-se desprotegido. A água possui, então, um dipolo bastante forte, com uma das cargas (positiva) bastante localizada. Esse próton pode interagir com as regiões negativas (o oxigênio) de outras moléculas de água, resultando em uma forte rede de ligações intermoleculares. Essa interação é conhecida como ligação de hidrogênio, e ocorre entre átomos de hidrogênio ligados a elementos como o oxigênio, flúor ou nitrogênio, com átomos de O, N ou F de outras moléculas. Essa interação é a mais intensa de todas as forças intermoleculares.
Exercícios
1. (PUC) As pontes de hidrogênio aparecem:a) Quando o hidrogênio está ligado a um elemento muito eletropositivo;b) Quando o hidrogênio está ligado a um elemento muito eletronegativo;c) Em todos os compostos hidrogenados;d) Somente em compostos inorgânicos;e) Somente nos ácidos de Arrhenius.
2. (UFPA) Os insetos mostrados na figura não afundam na água devido ao (a)

a) Presença de pontes de hidrogênio, em função da elevada polaridade da molécula de água.b) Fato de os insetos apresentarem uma densidade menor que a da água.c) Elevada intensidade das forças de dispersão de London, em consequência da polaridade das moléculas de água.d) Interação íon – dipolo permanente, originada pela presença de substâncias iônicas dissolvidas na água.e) Imiscibilidade entre a substância orgânica que recobre as patas dos insetos e a água.
3. A seguir temos quatro substâncias representadas por suas moléculas:
a) C2H6b) H3C ─ CH2─ CH2─ OHc) H2C ─ CH2─ CH2 │ │OH OHd) C3H8
No estado líquido, os tipos de forças intermoleculares que existem em cada uma dessas substâncias são, respectivamente:a) Dipolo induzido, ligação de hidrogênio, dipolo-dipolo, dipolo induzidob)Dipolo induzido, ligação de hidrogênio, ligação de hidrogênio, dipolo induzidoc)Dipolo induzido, ligação de hidrogênio, dipolo induzido, dipolo-dipolod) Ligação de hidrogênio, dipolo-dipolo, dipolo-dipolo, ligação de hidrogênioe) Todas são ligações de hidrogênio.