Aprenda tudo sobre a Ligação Iônica e suas propriedades!
A ligação iônica é a única em que a transferência de elétrons é definitiva. Aprenda mais sobre o assunto com um vídeo vapt-vupt do professor Alan e depois leia o nosso super resumo![embed]https://www.youtube.com/watch?v=yBQpKprM8FA&feature=youtu.be[/embed]
Uma ligação iônica envolve forças eletrostáticas que atraem íons de cargas opostas. Íons são átomos em desequilíbrio elétrico e apresentam carga positiva ou negativa. Ocorre quando reagimos um metal com ametal ou um metal com hidrogênio.
Forma-se pela troca de elétrons, isto é, um metal doa definitivamente elétrons (transformando-se em cátion) a outro átomo de um não-metal que os recebe definitivamente (transformando-se em ânion). Assim, tanto o átomo do elemento metálico quanto o do não-metálico atingem configurações eletrônicas de gás nobre e, portanto, garantem suas estabilidades.
Exemplo: NaCl, o famoso sal de cozinha.
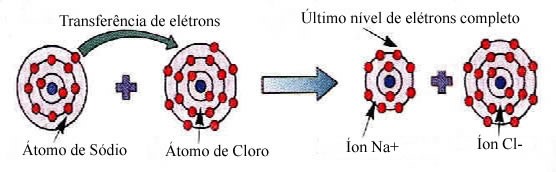
[caption id="attachment_58630" align="aligncenter" width="177"] Composição do Cloreto de sódio[/caption]
Composição do Cloreto de sódio[/caption]
O compartilhamento de elétrons ficaria assim:
Vamos observar o seguinte:- O átomo de Sódio doa um elétron para o átomo de Cloro;
- Forma-se o íon Na+ com oito elétrons na camada de valência (última camada da eletrosfera);
- O íon de cloro aparece com uma carga negativa (Cl-), indicando que recebeu um elétron e atingiu a estabilidade.
Fórmula eletrônica
Estruturas de Lewis ou fórmulas eletrônicas são representações dos pares de elétrons das ligações covalentes entre todos os átomos da molécula, bem como dos elétrons das camadas da valência que não participam das ligações covalentes.
Composto iônico
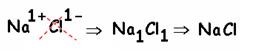
Propriedades gerais das ligações iônicas
- Compostos iônicos são constituídos por íons positivos e negativos dispostos de maneira regular formando um retículo;
- A ligação iônica é não-direcional (atração eletrostática estende-se igualmente em todas direções);
- Materiais muito duros. Alto ponto de fusão e ebulição (requer energia considerável para romper o retículo);
- Compostos iônicos conduzem corrente quando a substância se encontra fundida ou dissolvida. No estado sólido, conduzem somente quando apresentam defeitos;
- Reações de compostos iônicos são geralmente rápidas, pois basta a colisão entre as espécies;
- Quando solúveis, serão dissolvidos preferencialmente em solventes polares (água, ácidos minerais);
- Os grupos IA, IIA, VIA e VIIA são fortemente iônicos; outros compostos inorgânicos são parcialmente iônico-covalente (SiO2);
- Sólidas à temperatura ambiente;
- Cristais duros e quebradiços.
EXERCÍCIOS
1. (UNIMES-SP) Considerando as substâncias:I. HélioII. EnxofreIII. Cloreto de lítioIV. Cloreto de magnésioV. AmôniaDentre estas substâncias, apresentam ligações iônicas:Dados: 2He, 16S, 17Cl, 3Li, 12Mg, 7N, 1H
a) III e IVb) I e IVc) I e Vd) III e Ve) II e III
2. (UDESC-SC) Considere os seguintes elementos químicos: Na, Mg, S, H e Br. Os compostos iônicos formados entre esses elementos são:a) Na2S – MgS – NaH – MgH2 – MgBr2b) Na2S - MgS – H2S - NaBr – MgBr2 - HBrc) NaS - MgS – Mg2H - NaBr – Mg2Brd) NaS2 - MgS – NaH – Mg2H – NaBr – Mg2Bre) Na2S - MgS – NaBr – MgBr2 – Na2Mg
3. (UFRS) Um elemento “X” que apresenta a distribuição eletrônica em níveis de energia, K =2, L = 8, M = 8, N = 2, formando com:a) um halogênio Y um composto molecular XY.b) um calcogênio Z um composto iônico XZ.c) o hidrogênio um composto molecular HX.d) um metal alcalino M um composto iônico MX.e) um halogênio R um composto molecular X2R.