Questão 1
Questão 2
Questão 3
Questão 4
Questão 5
Questão 6
Reações de Adição
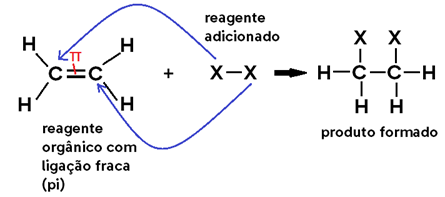
Falando de uma forma genérica, as reações de adição ocorrem quando ADICIONAMOS um reagente (geralmente inorgânico) a um composto orgânico, formando um único produto.
Para que isso ocorra, é necessário sempre haver uma LIGAÇÃO ENFRAQUECIDA NO REAGENTE ORGÂNICO, a qual se rompe, abrindo 2 valências livres. Ao mesmo tempo, o outro reagente adicionado ao orgânico também sofre uma cisão, e cada uma de suas partes se liga a uma valência livre do reagente orgânico.
Veja o caso geral abaixo, em que a ligação fraca é uma LIGAÇÃO PI:
IMPORTANTE À BEÇA:
Quando o composto for ALCADIENO CONJUGADO (ou seja, em que 2 ligações duplas são intercaladas por 1 ligação simples) e participar de uma reação de adição incompleta (com 1 mol de reagente com fórmula genérica X2), ocorrerá a chamada REAÇÃO 1,4, através da qual o produto formado em maior proporção sempre terá uma ligação dupla no lugar da ligação simples que intercalava as duplas no alcadieno reagente.
Veja:

Agora veja outro caso geral, em que a ligação fraca é uma LIGAÇÃO TENSIONADA EM CADEIA FECHADA:
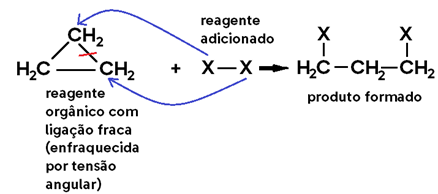
Atenção: tensão angular?
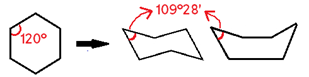
Essa teoria é chamada de “Teoria das tensões de Bayer”. Entenda: todos os carbonos dos ciclanos, por serem compostos cíclicos com ligações simples, possuem hibridização sp³, cujos ângulos entre os pares eletrônicos (geralmente nas ligações) devem ser 109°28’ para haver estabilidade, devido à geometria tetraédrica. No entanto, compostos de cadeia fechada possuem geometria que segue o padrão dos polígonos regulares, cada um com seus ângulos internos.
Exemplo: Ciclopropano -> possui geometria triangular, cujos ângulos internos são 60°, valor bem distante de 109°28’. Isso que gera uma tensão angular nessas ligações que as torna fracas, mais suscetíveis à ruptura.
OBS: O ciclo-hexano sofre deformação em sua estrutura, adquirindo forma de bote/barco ou de cadeira, nas quais o ângulo, em vez de 120° (ângulo interno do hexágono), é 109°28’. Essa deformação angular compensa a tensão angular, e a ligação entre os átomos de carbono deixa de ser fraca. Logo, não há tensão angular em anéis com 6 ou mais carbonos.
Hidrogenação catalítica
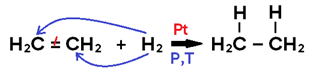
• Ocorre com ADIÇÃO DE H2 ao alceno, alcino, cicloalcano ou benzeno;
• Utiliza placa metálica de Pt, Ni ou Pd, que adsorve o H2, funcionando como CATALISADOR DE SUPERFÍCIE;
• Só ocorre sob TEMPERATURA E PRESSÃO ELEVADA;
• Em alceno, o produto formado é um alcano;
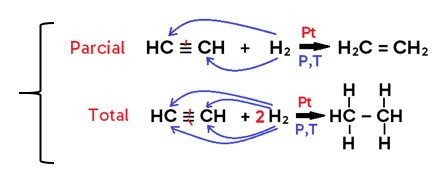
• Em alcino, o produto formado pode ser um alceno (caso se adicione 1 mol de H2, o que configura uma hidrogenação PARCIAL) ou um alcano (caso se adicionem 2 mols de H2, o que configura uma hidrogenação TOTAL);
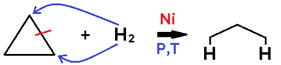
• Em cicloalcano, o produto formado é um alcano;
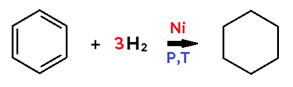
• Em benzeno, assim como em alceno e alcino, cada mol de H2 provoca a ruptura de 1 ligação pi, podendo formar cicloalceno ou cicloalcano.
Halogenação
Ocorre com ADIÇÃO DE Cl2, Br2 ou I2(halogênios moleculares, genericamente: X2) ao alceno, alcino ou cicloalcano;
OBS: F2 é tão reativo que gera uma reação explosiva, a qual não produz haletos; a reação com o I2 é muito lenta, motivo pelo qual quase não ocorre. Conclusão: vamos tomar como exemplos apenas cloração e bromação.
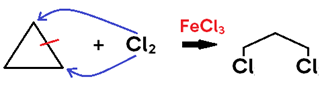
• Não necessita de catalisador para alceno e alcino, mas utiliza ÁCIDOS DE LEWIS (FeCl3, AlC3l, etc) como catalisador para CICLOALCANO;
• Em alceno, o produto formado é um di-haleto saturado;
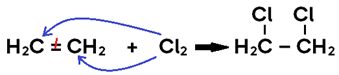
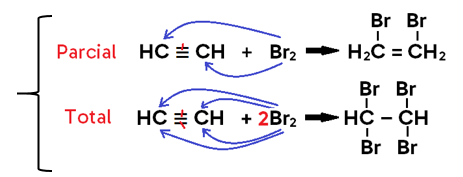
• Em alcino, o produto formado pode ser um di-haleto insaturado (caso se adicione 1 mol de X2, o que configura uma halogenação PARCIAL) ou um tetra-haleto saturado (caso se adicionem 2 mols de X2, o que configura uma halogenação TOTAL);
• Em cicloalcano, o produto formado é um di-haleto saturado;
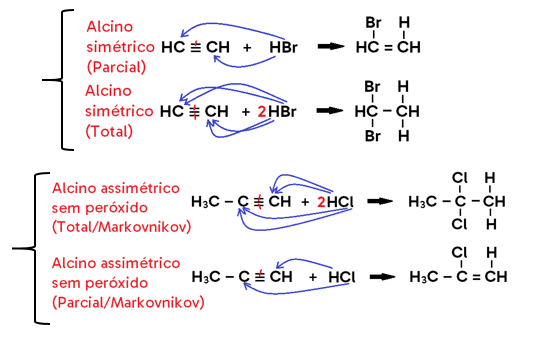
Hidro-halogenação
• Ocorre com ADIÇÃO DE HCl ou HBr (genericamente: HX) ao alceno, alcino ou cicloalcano;
• Não necessita de catalisador;
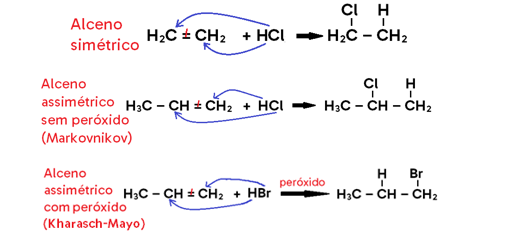
• Caso ocorra na AUSÊNCIA DE PERÓXIDO (peróxido de benzoíla, peróxido de hidrogênio, etc), utiliza-se a regra de MARKOVNIKOV;
Atenção!: Markovnikov?
Diz que quando a ligação dupla for assimétrica (isto é, o ligante de um lado da dupla é diferente do ligante do outro), o produto principal será aquele em que o H se adiciona ao CARBONO MAIS HIDROGENADO da dupla, enquanto o halogênio se liga ao menos hidrogenado. Como o produto secundário (em que o halogênio se liga ao carbono mais hidrogenado e o H se liga ao menos hidrogenado) é formado em quantidade muito menor, considera-se a formação apenas do produto principal.
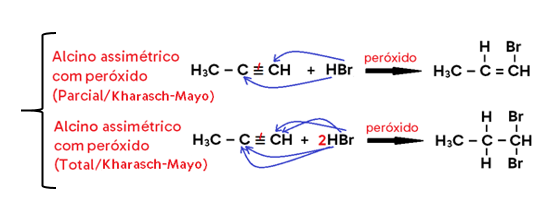
• Caso ocorra na PRESENÇA DE PERÓXIDO, utiliza-se a regra de ANTI-MARKOVNIKOV ou regra de KARASH-MAYO;
Atenção! : Kharasch-Mayo?
Diz que quando a ligação dupla for assimétrica e a hidro-bromação ocorrer na presença de peróxido, o produto principal formado será aquele em que o H se adiciona ao CARBONO MENOS HIDROGENADO da dupla, enquanto o bromo se liga ao mais hidrogenado. Da mesma forma, o produto secundário (em que ocorre o inverso) é formado em quantidade muito menor, motivo pelo qual desconsideramos sua formação.
Importante: Kharasch-Mayo ocorre apenas para o HBr na presença de peróxido!
• Em alceno, o produto formado é um haleto saturado;
• Em alcino, o produto formado pode ser um haleto insaturado (caso se adicione 1 mol de HX, o que configura uma hidro-halogenação PARCIAL) ou um di-haleto saturado com 2 halogênios ligados ao mesmo carbono (caso se adicionem 2 mols de HX, o que configura uma hidro-halogenação TOTAL);
• Em cicloalcano, o produto formado é um haleto saturado.
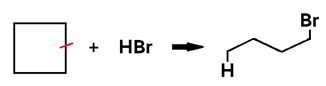
Obs.: Ciclopentano e ciclohexano não sofrem hidro-halogenação.
Hidratação
• Ocorre com ADIÇÃO DE ÁGUA (para fins didáticos, vamos representá-la por HOH) ao alceno, alcino ou cicloalcano;
• Só ocorre em MEIO ÁCIDO e sob AQUECIMENTO;
• Em compostos assimétricos, vale a regra de MARKVNIKOV;
• Em alceno, há formação de álcool;
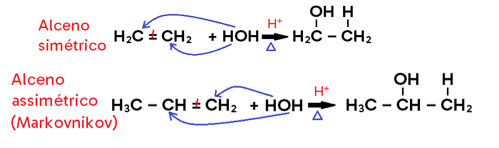
• Em alcino, há formação de enol, que entra em equilíbrio dinâmico (tautomeria) com aldeído ou cetona;
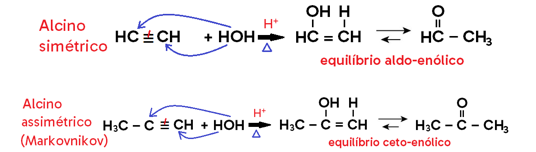
• Em cicloalcano, há formação de álcool.
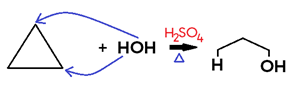
Obs.: Ciclopentano e ciclo-hexano não sofrem hidratação.
Reação de Grignard
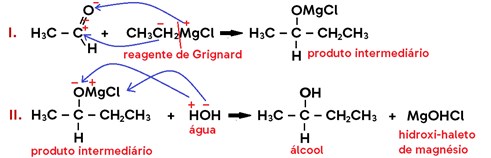
• Ocorre com a ADIÇÃO DE HALETO DE MAGNÉSIO (também chamado reagente de Grignard, e com fórmula molecular RMgX, em que R é um radical orgânico e X é um halogênio) e, posteriormente, de ÁGUA a um composto que contenha carbonila (aldeído ou cetona);
• Sempre há formação de um álcool e um hidroxi-haleto de magnésio (de fómula molecular MgOHX);
• Ocorre em 2 reações, entre as quais se forma um composto intermediário;
• Vejamos como ocorre a reação de adição de cloreto de etilmagnésio ao etanal:
Reação de eliminação
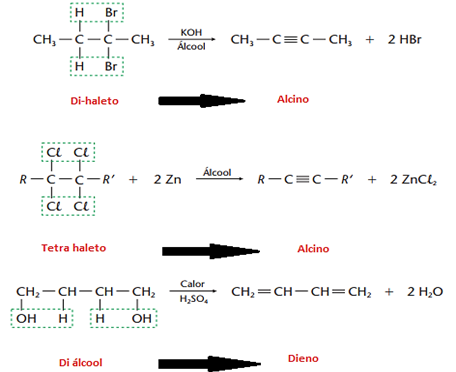
Reações de eliminação nada mais são, reações que acontecem saída de dois átomos ou grupos vizinhos com a formação de uma ligação dupla ou ciclização da cadeia em casos mais raros. Basicamente, existem quatro tipos de reação de eliminação:
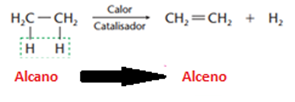
a) Eliminação de hidrogênio (desidrogenação)
A partir dos alcanos (existentes em grande quantidade no petróleo) obtemos alcenos, por isso essa reação é de grande importância na indústria petroquímica.
b) Eliminação de halogênios (de-halogenação)
Na eliminação de halogênios, que são eletronegativos, usamos um metal por ser eletropositivo (geralmente Zinco), catalisado por um álcool
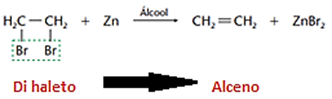
c) Eliminação de halogenidretos, HCl, HBr, HI (desidro-halogenação)
Esse tipo de reação é obtida por meio de KOH em dissolvida em álcool, e faz sentido, pois éinteressante usar uma base (KOH) para arrancar um ácido (HCl, HBr, HI…) de uma molécula orgânica. Se seu reagente for um haleto de cadeias maiores, haverá maior tendência de o hidrogênio sair do carbono menos hidrogenado. Esta é a regra de Saytzef, que basicamente é o inverso da regra de Markownikoff. Temos duas possibilidades para, por exemplo, o 2–bromo-butano, veja:
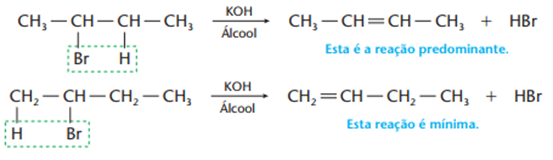
Ricardo Feltre, volume único, 6ª ed, 2004.
d) Eliminação de água (desidratação)
• Desidatração intramolecular (ocorre na própria molécula de álcool)
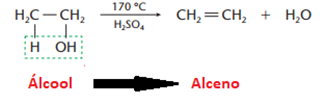
• Desidatração intermolecular (ocorre entre duas moléculas de álcoois iguais ou diferentes, com formação de éter)

Se o reagente for um álcool de cadeia maior, haverá também obediência à regra de Saytzef, como vemos no exemplo abaixo:
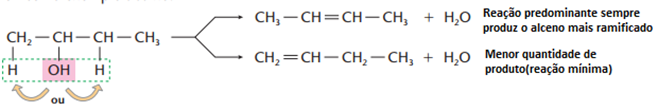
Ricardo Feltre, volume único, 6ª ed, 2004.
Obs.: Essa reação é comum para álcoois primários. Álcoois secundários e principalmente terciários tendem a desidratar-se intramolecularmente, tendo como produto, os alcenos correspondentes.
• Desidratação de ácidos carboxílicos
Aqui, há formação do anidrido do ácido correspondente:
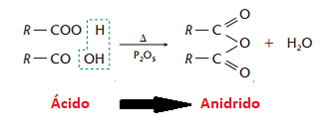
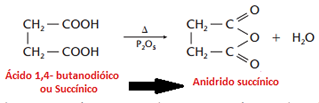
Os anidridos cíclicos mais estáveis são aqueles com 5 e 6 átomos de carbono, de acordo com a teoria das tensões de Baeyer:
Obs.: Apenas o ácido fórmico não dá anidrido
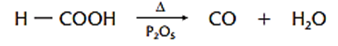
Eliminações Múltiplas ou sequenciais
Pode ocorrer reações de eliminação duas vezes na mesma molécula, assim, teremos a formação de uma ligação tripla ou de duas ligações duplas, como vemos abaixo: