Octanagem, equação de combustão e balanceamento de reações químicas
Carbono quiral e desidratação intramolecular
Orientação orto, meta e para
Estrutura plana
Funções orgânicas e polimerização
Exercício de orientação orto, meta e para
Exercício de reação de combustão e polimerização
Transesterificação e a produção de biodiesel
Reações orgânicas e nomenclatura de compostos orgânicos
Eliminação de água (desidratação)
• Desidatração intramolecular (ocorre na própria molécula de álcool)
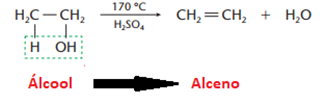
• Desidatração intermolecular (ocorre entre duas moléculas de álcoois iguais ou diferentes, com formação de éter)

Se o reagente for um álcool de cadeia maior, haverá também obediência à regra de Saytzef, como vemos no exemplo abaixo:
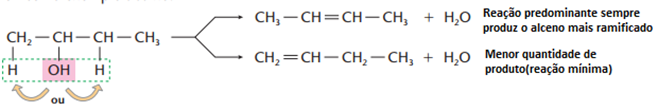
Ricardo Feltre, volume único, 6ª ed, 2004.
Obs.: Essa reação é comum para álcoois primários. Álcoois secundários e principalmente terciários tendem a desidratar-se intramolecularmente, tendo como produto, os alcenos correspondentes.
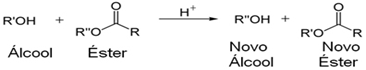
Transesterificação
• Ocorre entre um ÁLCOOL e um ÉSTER;
• Há a reação do radical do álcool com o carboxilato do éster;
• Utiliza ácido ou base forte como catalisador;
• Os produtos formados são um outro ÁLCOOL e um outro ÉSTER.
Reações de polimerização
A produção de polímeros sintéticos se dá pelas reações de polimerização – as reações que formam ligações entre os monômeros para propagar a cadeia polimérica – que se classificam em reações de adição (poliadição) ou condensação (policondensação).
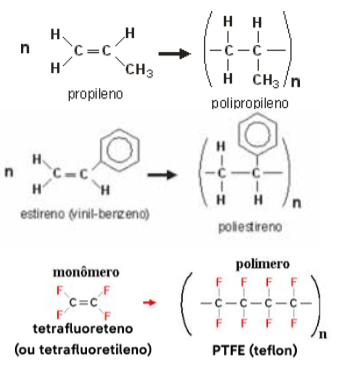
Poliadição
Ocorre a quebra de ligações duplas dos monômeros em uma reação rápida e exotérmica, geralmente catalisada por metais como a platina. É o principal processo de obtenção de plásticos como polietileno, PP, PVC, politetrafluoretileno (PTFE – teflon) e poliestireno (isopor). Estes materiais são chamados polímeros de adição.
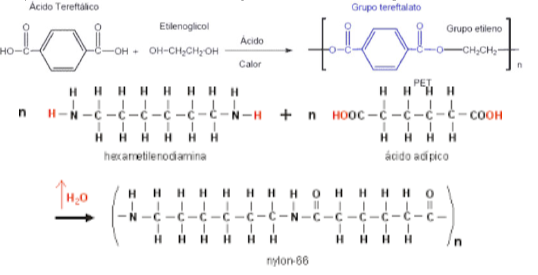
Policondensação
A extensão da cadeia ocorre através de reações de condensação de grupos funcionais (reações com formação de ligação entre duas moléculas, com perda de uma molécula pequena, geralmente água), como aminas, álcoois e ácidos carboxílicos. Esta reação é tipicamente mais lenta que a poliadição. Entre os polímeros produzidos desta forma estão: poliésteres (PET, dácron, terilene), poliamidas (nylon), silicones e policarbonato. Estes são chamados polímeros de condensação.
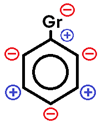
Orientação/diligência dos compostos aromáticos nas reações de substituição
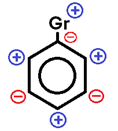
Nas reações de substituição de compostos aromáticos nos quais já se encontra algum grupo (Gr) ligado ao anel aromático, esse grupo pode direcionar a substituição dos hidrogênios das posições ORTO, META ou PARA.
Gr → grupo orientador
• Grupos ORTO-PARA dirigentes ou ATIVANTES: são grupos que direcionam a reação de substituição eletrofílica nas posições orto (1,2) e para (1,4). Eles são formados por 1 ÚNICO ÁTOMO ou por um grupo de átomos que estão unidos entre si apenas por LIGAÇÕES SIGMA (ligações simples).
Ex: Cl–, Br–, I–, OH–, –CH3, etc.
• OPA, eletrofílico?
São grupos que, por serem positivos, têm afinidade por elétrons (grupos negativos).
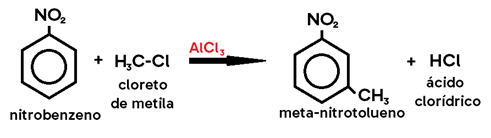
Exemplo: nitração do metilbenzeno (tolueno) → metil é um grupo orto-para dirigente.
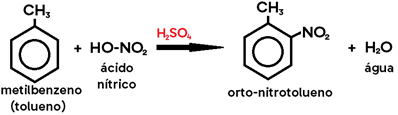
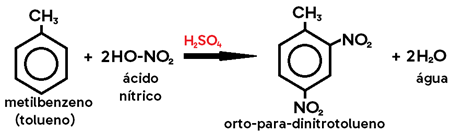
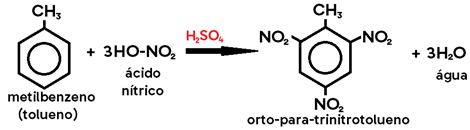
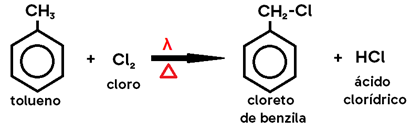
Obs.: Na halogenação do tolueno, caso os catalisadores utilizados sejam LUZ (λ) e CALOR (Δ), no lugar do ácido de Lewis, os produtos formados são HALETO DE BENZILA e HIDRÁCIDO HALOGENADO, pois o hidrogênio substituído será o do grupo metil, e não do anel benzênico (uma vez que os alcanos sofrem substituição na presença de luz e calor).
Dizemos que estes casos obedecem à REGRA CCC: CALOR, já que há aquecimento para que ocorra esta reação; CLARIDADE, uma vez que ocorre em presença de luz; e CADEIA, pois se trata de uma substituição na estrutura da cadeia alifática.
Para que se obtenha o meta-bromotolueno, ao contrário do processo acima, deve-se utilizar ácido de Lewis em ambiente FRIO e ESCURO. Assim, dizemos que estes casos obedecem à REGRA NNN: NOITE, já que a reação ocorre no escuro; NEVE, uma vez que ocorre no frio; e NÚCLEO, pois se trata de uma substituição na estrutura do núcleo benzênico.
• Grupos META dirigentes ou DESATIVANTES: são grupos que direcionam a reação de substituição eletrofílica nas posições meta (1,3). Eles são formados por átomos que estão unidos entre si por LIGAÇÃO DUPLA, TRIPLA ou DATIVA (ligações pi).
Ex: –NO2, –HSO3H, –CH=CH2, etc.