Ácidos e Bases em Química Orgânica-Parte 1
Ácidos e Bases em Química Orgânica-Parte 2
Ácidos em Química Orgânica: fenóis
Ácidos em Química Orgânica: álcoois
Ácidos em Química Orgânica: alcinos verdadeiros e nitroalcanos
Bases em Química Orgânica: aminas - Parte 1
Bases em Química Orgânica: aminas - Parte 2
Ácidos e Bases em Química Orgânica: amidas
Propriedades Físicas dos Compostos Orgânicos: interações intermoleculares
Propriedades Físicas dos Compostos Orgânicos: massa molecular
Propriedades Físicas dos Compostos Orgânicos: organização dos átomos
Solubilidade dos compostos orgânicos - Parte 1
Solubilidade dos compostos orgânicos - Parte 2
Propriedades físicas dos compostos orgânicos
Neste módulo estudaremos as principais propriedades físicas dos compostos orgânicos.
Ponto de fusão e ebulição dos compostos orgânicos
Interações Intermoleculares
As forças intermoleculares são as forças que ocorrem entre uma molécula e a molécula vizinha.
Durante uma mudança de estado físico ocorre o afastamento ou a aproximação entre essas moléculas, rompendo ou formando ligações intermoleculares.
As forças intermoleculares podem ser do tipo: Dipolo induzido, Dipolo-dipolo ou ligação de hidrogênio.
Quanto mais fortes forem as forças intermoleculares entre as moléculas, mais será o ponto de fusão e ebulição da substância, pois mais difícil será de afastar uma molécula da sua molécula vizinha.
Ex.:

ATENÇÃO:
Os hidrocarbonetos ramificados possuem menor extensão para ação das forças intermoleculares, portanto para hidrocarbonetos de mesma fórmula molecular, os menos ramificados possuem maior ponto de ebulição.
Ex.: C5H12
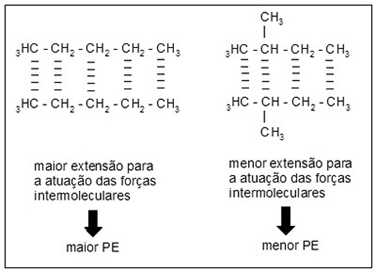
Veja que o hidrocarboneto ramificado possui menor ponto de ebulição que o hidrocarboneto não ramificado
de mesma fórmula molecular.
Massa molar
Quanto maior for a massa molar do composto, maior será o seu ponto de ebulição.
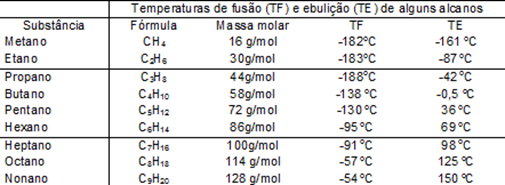
Ex.:
Comparando o ponto de ebulição dos alcanos não ramificados com 1 e 3 carbonos, com base na tabela acima, indique quem possui o maior ponto de ebulição.
Com base na tabela e nas respectivas massas molares, o C3H8 possui o ponto de ebulição maior que o CH4.
ATENÇÃO:
Quando comparamos os pontos de ebulição de hidrocarbonetos, por todos serem apolares e fazerem ligações de dipolo induzido, a massa molar será o fator decisivo para determinar quem possui maior ponto de ebulição.
Solubilidade dos compostos orgânicos
A solubilidade dos compostos orgânicos deve ser analisada a partir da polaridade e/ou apolaridade exercida pela sua estrutura molecular.
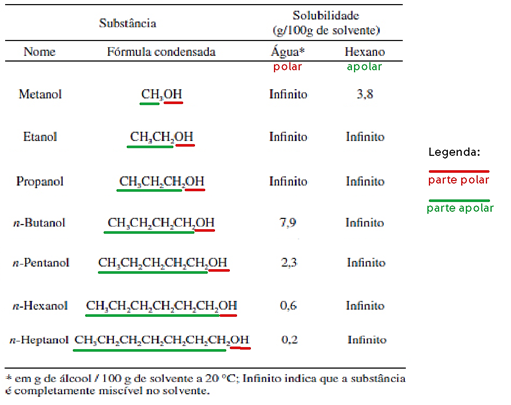
Sendo assim, é possível visualizar que com o aumento da parte apolar do hidrocarboneto há o aumento da solubilidade em hexano, que é um composto apolar. E a diminuição da solubilidade em água, que é um composto polar.
Vale lembrar, que o aumento da quantidade de hidroxilas (-OH), elevaria a polaridade da molécula, aumentando a solubilidade em água e diminuindo a solubilidade em hexano.
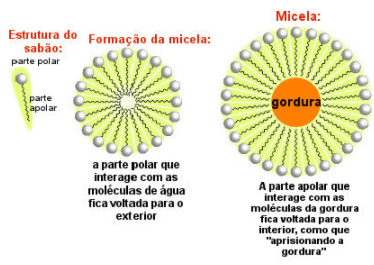
ATENÇÃO: Existem compostos orgânicos conhecidos como anfifílicos, são compostos que possuem tanto caráter polar quanto caráter apolar, ou seja, elas se solubilizam em compostos polares e apolares. Um ótimo exemplo dessas moléculas são os sabões. Os sabões são composto anfifílicos que conseguem se misturar tanto a água, quanto em gordura, sendo assim um ótimo agente de limpeza.
Veja a molécula dos saboões e as suas interações anfifílicas:
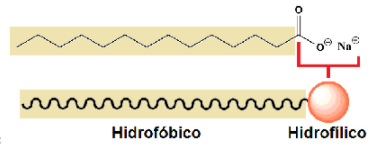
Estrutura do sabão: