Teoria ácido e base de Arrhenius e de Brønsted-Lowry
Ácidos orgânicos (ácido carboxílico)
Fenol e álcool
Alcino verdadeiro e nitroalcanos
Base orgânica - Amina
Caráter ácido
Os ácidos carboxílicos, quando em solução aquosa, se ionizam, originando íons H+(prótons) ou H3O+(íon hidrônio), portanto, segundo a teoria de Arrhenius são considerados ácidos. Genericamente e de maneira simplificada, temos:

Embora todos os ácidos carboxílicos sofram ionização, ela não ocorre na mesma intensidade em todos os compostos. Essa ionização está relacionada aos grupos ligados à carboxila:
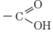
Esses grupos podem ser de dois tipos:
a) aqueles que aumentam a acidez.
Ex: halogênios (F, Cl, Br, I); NO2; OH etc.
b) aqueles que diminuem a acidez.
Ex: H3C ; C2H5 etc.
Isso corre quando átomos de diferentes eletronegatividades se encontram ligados ou bem perto no composto. O átomo mais eletronegativo tem a tendência de trazer os elétrons para perto dele, criando assim um dipolo. Esse dipolo pode ter um efeito estabilizante na molécula, pois ele “alivia” a carga excessiva em algumas ocasiões, acomodando melhor as cargas. Chamamos isso de efeito indutivo.
Isso pode ser verificado a partir da análise de alguns ácidos com substituintes diferentes e suas respectivas constantes de ionização, os quais são dados a seguir:
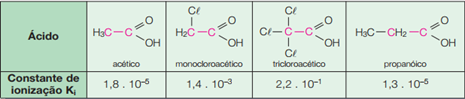
Obs1: Quanto maior a constante de ionização (Ki), mais ionizado estará o ácido. Assim, entre os ácidos apresentados, temos em ordem crescente de força de acidez:
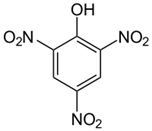
Obs2: O ácido pícrico é um ácido orgânico diferenciado, pois seus grupo nitro ligados a função fenol implicam o efeito indutivo, puxando os elétrons das ligações pi do anel aromático, deixando o H da hidroxila mais suscetível a sair. Esse ácido tem a acidez comparada dos ácidos inorgânicos apesar de ser uma molécula orgânica. Veja a fórmula do ácido pícrico abaixo.
Ácido propanóico < Ácido acético < Ácido monocloroacético < Ácido tricloroacético < Ácido pícrico
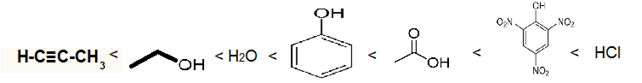
Acidez na química orgânica Além dos ácidos carboxílicos, na Química Orgânica existem outros compostos que se ionizam, liberando H+:
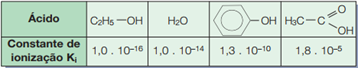
Obs: Alcinos verdadeiros são estruturas com ligação tripla onde essa instauração acontece no carbono da ponta da cadeia, ex: H – C ≡ C – H. São substâncias que não são ácidas em água, então para liberar seu hidrogênio é necessário reagir com sódio metálico.
Analisando suas constantes de ionização (Ki) podemos comparar o caráter ácido das funções:
Alcinos verdadeiros < Álcool < Água < Fenol < Ácido carboxílico < Ácido pícrico < Ácidos inorgânicos
Exemplo:
Caráter básico
Uma das principais características das aminas é o seu caráter básico por conta do par de elétrons livre(não ligante – Teoria de Lewis) existente no nitrogênio. Qualquer tipo de amina (primária, secundária e terciária) e a amônia reagem com a água e com os ácidos de forma semelhante:
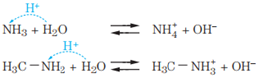
As aminas são consideradas as bases orgânicas, portanto, as substâncias que apresentarem grupo amina (NH2, NH ou N ) têm certo caráter básico. Um tipo de substância essencial à vida e que apresenta o grupo amina em sua estrutura são os aminoácidos (aa). Os mais importantes são os α(alfa)-aminoácidos, por serem os responsáveis pela síntese de proteínas:
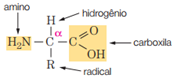
Como os aminoácidos apresentam dois grupos distintos(um com característica básica e outro ácida) chamamos essas substâncias de ANFÓTERAS por poderem reagir tanto com ácidos quanto com bases.
Força decrescente das bases orgânicas:
Secundária > primária > terciária > amônia > amina aromática > amina com dois anéis aromáticos
R2NH > RNH2 > R3NH2 > NH3 > ArNH2 > Ar2NH