Exercício 1: Relaciona as quantidades em mols com densidade, massa e volume dos participantes da reação
Exercício 2: Relaciona as quantidades em mols e massa dos participantes da reação
Exercício 3: Relaciona volume molar de gás e quantidades em mols dos participantes da reação
Exercício 4: Relaciona densidade, título em cálculo com excesso de reagente
Exercício 5: Equação de estado de gás ideal e relacão entre massa, densidade e quantidade em mols
Exercício 6: Pureza de reagente
Exercício 7: Pureza de reagente
Exercício 8: Relaciona as quantidades em mols dos participantes em uma reação de combustão
Cálculo estequiométrico ou estequiometria é o cálculo das quantidades de reagentes e/ou produtos das reações químicas baseados nas leis ponderais e proporções químicas.
Na estequiometria temos que estar cientes das informações quantitativas que uma reação química pode representar, por exemplo:

De acordo com as leis das reações, as proporções acima são constantes, e isso permite que eu monte uma regra de três para calcular as quantidades envolvidas numa reação genérica. Por exemplo:
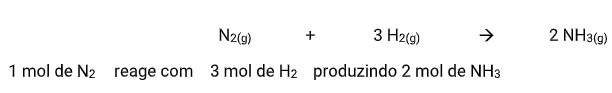
Sendo assim, caso eu queira saber quantos mol de amônia eu produzo com 10 mol de N2 basta eu montar uma regra de simples partindo da reação dada e relacionando o dado da questão (10 mol) com o X.
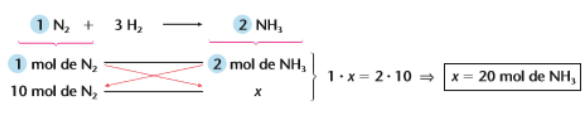
Portanto, se eu sei que 1 mol de N2 produzem 2 mol de NH3 eu posso chegar a conclusão que com 10 mol de N2 eu produzo 20 mol de NH3 .
Analogamente podemos utilizar qualquer uma das unidades apresentadas como dados ta questão, por exemplo usando a massa:
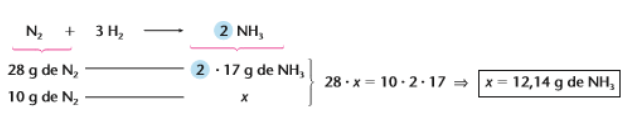
Como 1 mol de N2 equivale a 28g e produzem 34g de NH3, com uma regra de três simples consigo descobrir quanto de NH3 eu consigo produzir utilizando apensas 10g de N2.
Resumindo:
I. Escrever a equação química mencionada no problema.
II. Balancear ou acertar os coeficientes dessa equação (lembre-se de que os coeficientes indicam a proporção em mols existente entre os participantes da reação).
III. Estabelecer uma regra de três entre o dado e a pergunta do problema, obedecendo aos coeficientes da equação, que poderá ser escrita em massa, ou em volume, ou em mols, conforme as conveniências do problema.
Casos gerais
Quando o dado e a pergunta são expressos em massa
Calcular a massa de amônia (NH3) obtida a partir de 3,5 g de nitrogênio gasoso (N2) (massas atômicas: N = 14; H = 1).
Resolução:

Neste exemplo, a regra de três obtida da equação foi montada em massa (gramas), pois tanto o dado como a pergunta do problema estão expressos em massa.
- Quando o dado é expresso em massa e a pergunta em volume (ou vice-versa)
Calcular o volume de gás carbônico obtido, nas condições normais de pressão e temperatura, utilizando de 290 g de gás butano (massas atômicas: C = 12; O = 16; H = 1).
Resolução:
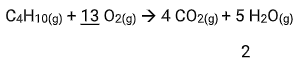
Lembrando a definição de Condições Normais de Temperatura e Pressão(P =1 atm ; T = 0ºC): 1 mol de qualquer gás na CNTP ocupam 22,4L.
58g de C4H10 __________ 4 x 22,4L de CO2
290g de C4H10 _______ X
X = 448L de CO2 (Nas CNTP)
Agora a regra de três é, “de um lado”, em massa (porque o dado foi fornecido em massa) e, “do outro lado”, em volume (porque a pergunta foi feita em volume).
- Quando o dado e a pergunta são expressos em volume
Um volume de 15 L de hidrogênio (H2), medido a 15° C e 720 mmHg, reage completamente com cloro. Qual é o volume de gás clorídrico(HCl) produzido na mesma temperatura e pressão?
Resolução:
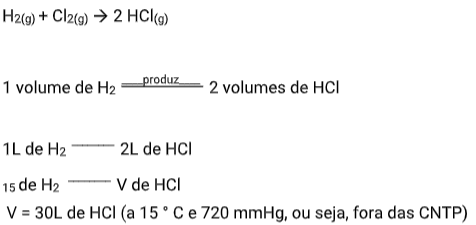
O cálculo estequiométrico entre volumes de gases é um cálculo simples e direto, desde que os gases (reagente e produto) estejam nas mesmas condições de pressão e temperatura.
- Quando o dado é expresso em massa e a pergunta em mols (ou vice-versa)
Quantos mols de gás oxigênio são necessários para produzir 0,45 gramas de água?
(Massas atômicas: H = 1; O = 16)
Resolução:
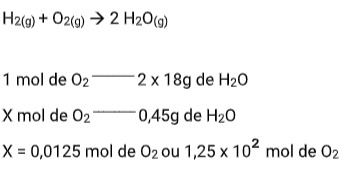
- Quando o dado é expresso em massa e a pergunta em número de partículas (ou vice-versa)
Quantas moléculas de gás carbônico podem ser obtidas pela queima completa de 4,8 g de carbono puro?
(Massa atômica: C = 12)
Resolução:
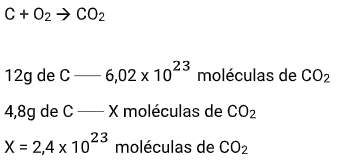
Havendo duas ou mais perguntas
(Neste caso, teremos uma resolução para cada uma das perguntas feitas)
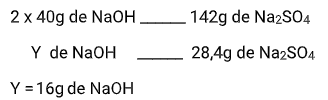
Quais são as massas de ácido sulfúrico e hidróxido de sódio necessárias para preparar 28,4 g de sulfato de sódio? (Massas atômicas: H = 1; O = 16; Na = 23; S = 32)
Para a massa do ácido sulfúrico (H2SO4):
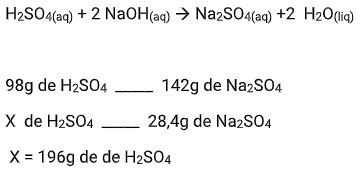
Para a massa do Hidróxido de sódio (NaOH):
Grau de pureza
Quando os reagentes não são substâncias puras (Grau de pureza) Em alguns casos na estequiometria os reagentes da reação apresentam em sua composição impurezas, principalmente em reações industriais, ou porque são mais baratos ou porque já são encontrados na natureza acompanhados de impurezas (o que ocorre, por exemplo, com os minérios). Consideremos o caso do calcário, que é um mineral formado principalmente por CaCO 3 (substância principal), porém acompanhado de várias outras substâncias (impurezas). Digamos que tenhamos 100kg do mineral calcário, porém, 90kg são compostos por CaCO 3 , que é o componente principal desse minério e o que necessariamente vai reagir numa reação química qualquer. Sendo assim, dizemos que 90% de todo minério recolhido é CaCO 3 , logo, 10kg são apenas impurezas, que, geralmente, não reagem e não entram no cálculo estequiométrico. Com essa análise chegamos a conclusão que essa amostra de minério tem 90% de pureza, ou seja, dos 100kg que nós recolhemos 90kg serão utilizados.
Sendo assim, define-se: Porcentagem ou grau de pureza é a porcentagem da massa da substância pura em relação à massa total da amostra.
Vejamos um exemplo:
Uma amostra de calcita, contendo 80% de carbonato de cálcio, sofre decomposição quando submetida a
aquecimento, segundo a equação abaixo:
CaCO3 → CaO + CO2
Qual a massa de óxido de cálcio obtida a partir da queima de 800 g de calcita?
Resolução:
O enunciado nos diz que a calcita contém apenas 80% de CaCO3 . Temos então o seguinte cálculo de
porcentagem:
1ª linha) 800 g de calcita _________ 100%
2ª linha) x g de CaCO3 _________ 80% de - Grau de pureza
X = 640g de CaCO3 puro
Note que é apenas essa massa (640g de CaCO3 puro) que irá participar da reação. Assim, teremos o
seguinte cálculo estequiométrico:
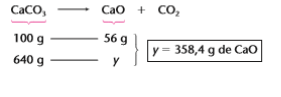
Gases fora das CNTP
Definimos a equação geral dos gases de Clapeyron para usar em gases que não estejam nas CNTP, ela é dada por:
PV = nRT
Podemos expressar o número de mol (n) da seguinte maneira também:
PV = m/MM RT
Onde:
P = Pressão do gás (atm)
V = Volume do gás (L)
n = Quantidade do gás (mol)
m = Massa do gás (g)
M.M = Massa molar do gás(g)
R = Constante universal dos gases perfeitos (L.atm/mol.K)
T = Temperatura do gás (medida em Kelvin)
Volume molar fora das CNTP (Condições Normais de Temperatura e Pressão)
Definimos que uma substância está fora das CNTP se as condições de temperatura e pressão são diferentes de 0ºC e 1 atm. Quando são usados valores diferentes para esses parâmetros calculamos seu
volume a partir da equação de Clapeyron.
Exemplo:
Dada a reação: Fe2O3(s) + 3CO (g) --> 2Fe (s) + 3CO2(g)
Sabendo que a massa de um mol de ferro é de 56g, calcule a massa de ferro produzida quando 8,2L de CO2 são formados a 2 atm e 127ºC.
Resolução:
Primeiramente amos calcular quantos litros de CO2 são produzidos quando, nas mesmas condições de temperatura e pressão dadas no texto, temos 3 mol do mesmo(quantidade estequiométrica de mol de gás CO2)
PV =nRT
2.V = 3 . 0,082 . 400
V = 49,2L
Assim, quando se produz 2 mol de ferro nas condições dadas eu produzo 49,2L de CO2, com uma regra de três, consigo estabelecer quantas gramas de ferro eu produziria com 8,2L de CO2.
2x56 gramas de ferro ______ 49,2L de CO2
Y gramas de ferro ______ 8,2L de CO2
Y = 18,7g de ferro (aproximadamente)