Introdução
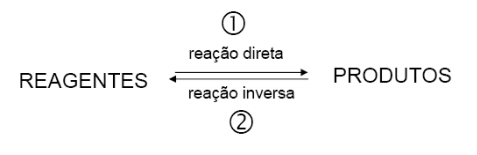
Reagentes, produtos e símbolos nas reações
Classificação das reações (Adição e decomposição)
Classificação das reações (Simples-troca e Dupla-troca)
Reações de oxi-redução
Balanceamento das reações por tentativas
Exercícios
Exercícios
Como ocorrem as reações químicas?
Duas ou mais substâncias reagindo para a formação de uma nova substância. Isso é uma transformação química, representada por uma reação. A afinidade é fundamental para que uma reação ocorra. Calor, temperatura, pressão e catalisador são exemplos de fatores que influenciam uma reação.
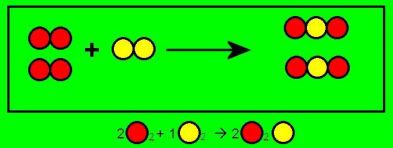
As reações químicas são processos que transformam uma ou mais substâncias, chamados reagentes, em outras substâncias, chamadas produtos. Os reagentes ficam à esquerda e os produtos, à direita. Anteriormente às substâncias, ficam os coeficientes, importantes para balancear uma reação química.
Na química inorgânica podemos classificar as reações em quatro tipos diferentes:
I - Adição ou síntese
As reações de adição ou síntese são aquelas onde substâncias se juntam formando uma única substância.
R1 + R2 + Rn → Produto
- Síntese total
Somente substâncias simples no reagente.
Ex.: C + O2 → CO2
S + O2 + H2 → H2SO4
- Síntese parcial
Pelo menos uma substância composta nos reagentes.
Ex.: SO2 + ½ O2 → SO3
CaO + H2O → Ca(OH)2
II - Decomposição ou análise
As reações de decomposição ou análise são aquelas onde uma substância dá origem a duas ou mais substâncias.
Reagente → P1 + P2 + Pn
Ex:
CaCO3 → CaO + CO2 Pirólise
H2O → H2 + O2 Eletrólise
2Ag2O → 4Ag + O2 Fotólise
III - Simples troca ou deslocamento
As reações de simples troca ou deslocamento são aquelas onde existe a substituição do cátion ou do ânion de uma substância por um novo cátion ou ânion derivado de uma substância simples.
Deslocamento do cátion:
AB + C → CB + A
Deslocamento do ânion:
AB + D → AD + B
Tabela de reatividade dos metais:

Deslocamento do ânion:
Ocorre: 2KBr + Cl2 → 2KCl + Br2
O Cl é mais reativo que o Br, portanto, consegue substituí-lo no KBr.
Não ocorre: 2NaCl + I2 → X
O I é menos reativo que o Cl, portanto, não consegue substituí-lo no NaCl.
Tabela de reatividade dos ametais:
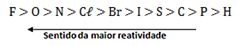
IV - Dupla troca ou permutação
As reações de dupla troca ou permutação são aquelas que ocorrem entre substâncias compostas, havendo uma troca de espécies químicas que resulta na formação de novas substâncias compostas.
AB + CD → AD + CB
Obs.: Condições para ocorrência das reações de dupla troca
- Formação de eletrólitos fracos
Na2S + H2SO4 → H2S (eletrólito fraco) + Na2SO4 - Formação de gás
CaCO3 + HCl → H2O + CO2(gás) + CaCl2 - Formação de precipitado
AgNO3 + NaCl → AgCl(precipitado - sólido) + NaNO3
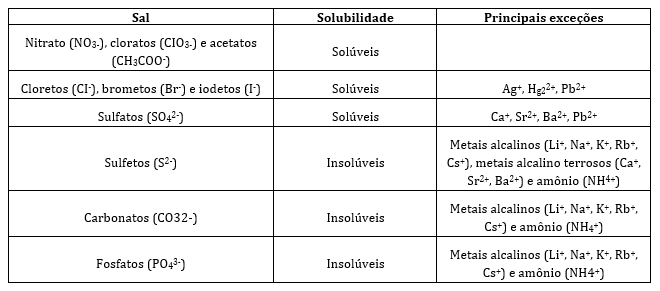
Tabela de solubilidade
V – Reações de oxirredução
Reações de redox, são as que ocorrem com transferência de um ou mais elétrons entre as espécies participantes.
Exemplo: Fe + 2HCl → FeCl2 + H2
Para saber se a reação é de oxirredução basta determinar o nox de cada átomo e verificar se, aos pares, o nox muda.
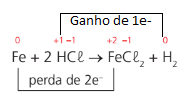
Obs.: O número de elétrons ganhos deverá ser igual ao número de elétrons perdidos.
- Oxidação e agente redutor
É o fenômeno da perda de elétrons. A espécie química, ao sofrer oxidação, tende a ceder elétrons, sendo considerado o agente redutor da reação. - Redução ou agente oxidante
É o fenômeno do ganho de elétrons. A espécie química, ao sofrer redução, tende a receber elétrons, sendo considerada o agente oxidante da reação.
Dica para lembrar:
Quem sofre Oxidação: Perde elétrons → É agente Redutor
Quem sofre Redução: Ganha elétrons → É agente Oxidante
VI - Balanceamento de equações por tentativa
Existem alguns métodos modos para se fazer balanceamento de reações, entre eles, o método das tentativas (MACHO) é um dos mais utilizados.
Método das tentativas: Consiste em colocar os coeficientes, ao seu modo, até igualar o número de átomos dos reagentes (lado esquerdo da seta) com os produtos (lado direito da seta). Podemos adotar uma sequência para facilitar a definição dos coeficientes, que chamamos de MACHO:
- Metais
- Ametais
- Carbono
- Hidrogênio
- Oxigênio