Definição de solução tampão
Tampão ácido
Tampão básico
Questão sobre o pH do sangue
Questão sobre uma solução tampão Hac NaAc
Soluções tampão são aquelas que resistem a variações de pH, quando nelas são adicionados ácidos e bases. Existem tampões ácidos e básicos, mas ambos resistem à adição tanto de ácidos como de bases. Nosso sangue, por exemplo, mantém seu pH entre 7,35 e 7,45, mesmo quando bebemos um refrigerante, que possuem alta concentração de H+. Qual é a composição de uma solução tampão? Vamos ver separadamente os tampões ácido e básico.
Tampão ácido: composto por um ácido fraco e um sal derivado dele.
Exemplo: H2CO3 (ácido carbônico, fraco) e NaHCO3 (bicarbonato de sódio, sal derivado). Esses compostos formam os seguintes equilíbrios, respectivamente:
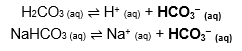
Com esses dois equilíbrios ocorrendo ao mesmo tempo no meio, se adicionarmos:
• Um ácido: A concentração de H+ aumenta, mas como o equilíbrio se desloca rapidamente no sentido de consumir esse cátion – e, ao mesmo tempo, de formar a forma não ionizada do ácido –, o pH não se altera, isto é, o efeito da alteração é tamponado.
Obs: A presença de NaHCO3 no sistema é importante porque oferece mais íons HCO3− para reagirem com o H+, formando H2CO3 e mantendo o pH. Se aumentássemos a concentração de H+ e não houvesse HCO3− suficiente para consumi-lo, o pH diminuiria.
• Uma base: A concentração de OH– aumenta e reage com os íons H+ da solução, formando água. Isso obviamente geraria uma redução na concentração de H+ do sistema, mas como o equilíbrio se desloca rapidamente no sentido de o repor, o pH não aumenta, isto é, o efeito da alteração é tamponado.
Tampão básico: composto por uma base fraca e um sal derivado dela.
Exemplo: NH4OH (hidróxido de amônio, fraco) e NH4Cl (cloreto de amônio, sal derivado). Esses compostos formam os seguintes equilíbrios, respectivamente:
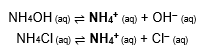
Com esses dois equilíbrios ocorrendo ao mesmo tempo no meio, se adicionarmos:
• Uma base: A concentração de OH– aumenta, mas como o equilíbrio se desloca rapidamente no sentido de consumir esse ânion – e, ao mesmo tempo, de formar a forma não dissociada da base –, o pH não se altera, isto é, o efeito da alteração é tamponado.
Obs: A presença de NH4Cl no sistema é importante porque oferece mais íons NH4+ para reagirem com o OH–, formando NH4OH e mantendo o pH. Se aumentássemos a concentração de OH– e não houvesse NH4+ suficiente para consumi-lo, o pH aumentaria.
• Um ácido: A concentração de H+ aumenta e reage com os íons OH– da solução, formando água. Isso obviamente geraria uma redução na concentração de OH– do sistema, mas como o equilíbrio se desloca rapidamente no sentido de o repor, o pH não diminui, isto é, o efeito da alteração é tamponado.
Importante à beça:
Existe uma zona de tamponagem, que, se for ultrapassada, o tampão “quebra”. Ou seja, se adicionarmos muito muito muito ácido ou muita muita muita base ao sistema, provavelmente o pH se alterará, uma vez que o tampão não fará efeito.
Matematicamente falando:
Existe uma fórmula que nos permite calcular o valor do pH/pOH de uma solução tampão, quando sabemos o Ki do ácido ou da base, a concentração do ácido ou da base e a concentração do sal derivado.
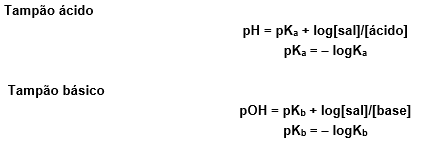
Obs: Transformamos o Ki em potencial de Ki (pKi) pelo mesmo motivo que transformamos a concentração de H+ por potencial hidrogeniônico (pH), por exemplo para não utilizarmos valores tão pequenos nas contas, o que facilita a nossa vida. Repare que pKi é calculado de forma idêntica à do pH/pOH.
Trazendo para a vida:
Como já vimos, o sangue humano possui valores de pH que, em seu estado de normalidade, variam de 7,35 a 7,45. Valores que não se encontram nesse intervalo acusam acidose (se for <7,35) ou alcalose (se for >7,45) sanguíneas, que precisam ser revertidas a fim de que o organismo não seja prejudicado. Valores de pH superiores a 7,95 e inferiores a 6,85 já podem levar uma pessoa à morte.
O tampão sanguíneo é esse:
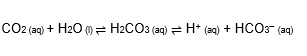
Obs: A proporção de HCO3− para H2CO3 não é 1:1, como sugere a equação. O íon bicarbonato, na verdade, se encontra em quantidade muito superior à do ácido, devido à presença de sais derivados dele, o que faz desse tampão ligeiramente básico.
Acidose respiratória: Ocorre quando há excesso de CO2 no sangue, por não termos exalado gás carbônico suficiente, o que aumenta a pressão parcial desse gás (pCO2). Assim, o equilíbrio se desloca no sentido de consumir CO2, aumentando a concentração de ácido, que se ioniza mais em H+ e HCO3− e diminui o pH;
Alcalose respiratória: Ocorre quando há carência de CO2 no sangue, por termos exalado mais gás carbônico que o aceitável, o que diminui a pressão parcial desse gás (pCO2). Assim, o equilíbrio se desloca no sentido de produzir CO2, diminuindo a concentração de ácido, que se ioniza menos em H+ e HCO3− e aumenta o pH;
Acidose metabólica: Ocorre quando há baixa concentração de HCO3−, o que aumenta a ionização do ácido e diminui o pH;
Alcalose metabólica: Ocorre quando há alta concentração de HCO3−, o que diminui a ionização do ácido e aumenta o pH.