Exercício sobre Solução Tampão 1
Exercício sobre Solução Tampão 2
Exercício sobre Kps 1
Exercício sobre Kps 2
Solução Tampão
Soluções tampão são aquelas que resistem a variações de pH, quando nelas são adicionados ácidos e bases. Existem tampões ácidos e básicos, mas ambos resistem à adição tanto de ácidos como de bases. Nosso sangue, por exemplo, mantém seu pH entre 7,35 e 7,45, mesmo quando bebemos um refrigerante, que possuem alta concentração de H+.
Qual é a composição de uma solução tampão? Vamos ver separadamente os tampões ácido e básico.
Tampão ácido
composto por um ácido fraco e um sal derivado dele.
Exemplo: H2CO3 (ácido carbônico, fraco) e NaHCO3 (bicarbonato de sódio, sal derivado). Esses compostos formam os seguintes equilíbrios, respectivamente:
H2CO3(aq) ⇌ H+(aq) + HCO3− (aq)
NaHCO3 (aq) ⇌ Na^++ (aq) + HCO3− (aq)
Com esses dois equilíbrios ocorrendo ao mesmo tempo no meio, se adicionarmos:
Um ácido
A concentração de H+ aumenta, mas como o equilíbrio se desloca rapidamente no sentido de consumir esse cátion – e, ao mesmo tempo, de formar a forma não ionizada do ácido –, o pH não se altera, isto é, o efeito da alteração é tamponado
Obs: A presença de NaHCO3 no sistema é importante porque oferece mais íons HCO3− para reagirem com o H+, formando H2CO3 e mantendo o pH. Se aumentássemos a concentração de H+ e não houvesse HCO3− suficiente para consumi-lo, o pH diminuiria.
Uma base
A concentração de OH− aumenta e reage com os íons H+ da solução, formando água. Isso obviamente geraria uma redução na concentração de H+ do sistema, mas como o equilíbrio se desloca rapidamente no sentido de o repor, o pH não aumenta, isto é, o efeito da alteração é tamponado.
Tampão básico
Composto por uma base fraca e um sal derivado dela.
Exemplo: NH4OH (hidróxido de amônio, fraco) e NH4Cl (cloreto de amônio, sal derivado). Esses compostos formam os seguintes equilíbrios, respectivamente:
NH4OH (aq) ⇌ NH4+ (aq) + OH– (aq)
NH4Cl (aq) ⇌ NH4+ (aq) + Cl– (aq)
Com esses dois equilíbrios ocorrendo ao mesmo tempo no meio, se adicionarmos:
Uma base
A concentração de OH– aumenta, mas como o equilíbrio se desloca rapidamente no sentido de consumir esse ânion – e, ao mesmo tempo, de formar a forma não dissociada da base –, o pH não se altera, isto é, o efeito da alteração é tamponado.
Obs: A presença de NH_44Cl no sistema é importante porque oferece mais íons NH4+ para reagirem com o OH–, formando NH_44OH e mantendo o pH. Se aumentássemos a concentração de OH– e não houvesse NH_44^++ suficiente para consumi-lo, o pH aumentaria.
Um ácido
A concentração de H+ aumenta e reage com os íons OH– da solução, formando água. Isso obviamente geraria uma redução na concentração de OH– do sistema, mas como o equilíbrio se desloca rapidamente no sentido de o repor, o pH não diminui, isto é, o efeito da alteração é tamponado.
Importante à beça:
Existe uma zona de tamponagem, que, se for ultrapassada, o tampão “quebra”. Ou seja, se adicionarmos muito muito muito ácido ou muita muita muita base ao sistema, provavelmente o pH se alterará, uma vez que o tampão não fará efeito.
Matematicamente falando:
Existe uma fórmula que nos permite calcular o valor do pH/pOH de uma solução tampão, quando sabemos o Ki do ácido ou da base, a concentração do ácido ou da base e a concentração do sal derivado.
Tampão ácido:
pH = pKa + log[sal]/[ácido]
pKa = – logKa
Tampão básico:
pOH = pKb + log[sal]/[base]
pKb = – logKb
Obs: Transformamos o Ki em potencial de Ki (pKi) pelo mesmo motivo que transformamos a concentração de H+ por potencial hidrogeniônico (pH), por exemplo 🡪 para não utilizarmos valores tão pequenos nas contas, o que facilita a nossa vida. Repare que pKi é calculado de forma idêntica à do pH/pOH.
Acidose respiratória
Ocorre quando há excesso de CO2 no sangue, por não termos exalado gás carbônico suficiente, o que aumenta a pressão parcial desse gás (pCO2). Assim, o equilíbrio se desloca no sentido de consumir CO2, aumentando a concentração de ácido, que se ioniza mais em H+ e HCO3− e diminui o pH;
Alcalose respiratória
Ocorre quando há carência de CO2 no sangue, por termos exalado mais gás carbônico que o aceitável, o que diminui a pressão parcial desse gás (pCO2). Assim, o equilíbrio se desloca no sentido de produzir CO2, diminuindo a concentração de ácido, que se ioniza menos em H+ e HCO3− e aumenta o pH;
Acidose metabólica
Ocorre quando há baixa concentração de HCO3−, o que aumenta a ionização do ácido e diminui o pH;
Alcalose metabólica
Ocorre quando há alta concentração de HCO3−, o que diminui a ionização do ácido e aumenta o pH.
Constante do produto de solubilidade (KPS)
Sabemos que cada composto possui um grau ou coeficiente de solubilidade, que é a relação/divisão entre a quantidade do composto em questão(soluto) e a quantidade de água que formam uma solução saturada desse soluto. Ou seja, se a quantidade de soluto pela quantidade de água de uma solução supera a solubilidade desse composto, a quantidade excedente do mesmo se cristaliza e precipita, formando o precipitado, para evitar que a solução fique supersaturada.
O que vamos estudar aqui é o equilíbrio que se estabelece entre os íons dissociados do soluto e o precipitado (íons não dissociados), atingido quando a velocidade de dissolução se iguala à de precipitação. Acontece assim com o cloreto de sódio, por exemplo:
NaCl(s) ⇌ Na+ (aq) + Cl- (aq)
Como todo bom equilíbrio químico, este também tem sua constante, seu padrão que varia com a temperatura: a constante do produto de solubilidade. Para o caso do NaCl, calculamos da seguinte forma
KPS = [Produtos]
KPS = [Na+][Cl−]
OBS: Sólidos não entram na equação da constante de equilíbrio, lembra disso? Segue a regra. Por isso não temos os reagentes, que nesse caso são sempre sólidos. Quanto maior o Kps de um são mais é a quantidade de íons dissociados do soluto. Observe o gráfico:
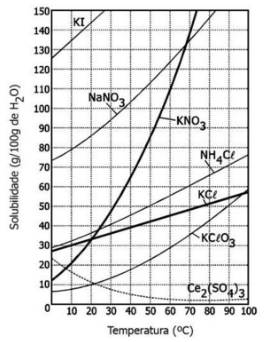
50°C o NaNO3 possui o maior Kps, ou seja, ele possui a maior quantidade de íons dissociados em relação ao seu sal que os demais sais do gráfico. Já o Ce2(SO4)3 é o que possui a menor relação.
PSIU!
No caso da retirada de solvente de uma solução com mais de um sal diferentes entre si, o sal de menor Kps é o primeiro a precipitar.
Solubilidade (S) de um soluto é a concentração dele (geralmente concentração molar) que fica dissociada na solução, que não compõe o precipitado, a determinada temperatura. Logo, as concentrações de Na+ e Cl– que entram na equação do KPS são, cada uma, justamente a solubilidade do NaCl.
Assim, se sabemos o valor de S do NaCl, calculamos o KPS dele assim:
KPS = S x S
KPS = S²
Que tal mais um exemplo para entender 100%? Vamos ao PbCl2. Considerando que a solubilidade dele a 25°C seja S. Qual será o seu KPS, na mesma temperatura?
PbCl2 (s) ⇌ Pb2^+ (aq) + 2 Cl− (aq)
Se a solubilidade do PbCl2 é S, a concentração de íons Pb^2+ na solução será S e a de Cl− será 2S, já que a proporção de PbCl2:Pb2+:Cl− é 1:1:2. Logo, KPS será:
proporção de PbCl2:Pb2+:Cl– é 1:1:2. Logo, KPS será:
KPS = [Pb2+][Cl–]²
KPS = S.(2S)²
KPS = 4S³