Síntese e decomposição
Simples troca e dupla troca
Condições para ocorrência de simples troca
Condições para ocorrência de dupla troca
Substâncias solúveis e voláteis que você deve saber
Resumo sobre força dos ácidos e bases
As reações químicas são processos que transformam uma ou mais substâncias, chamados reagentes, em outras substâncias, chamadas produtos.
Na química inorgânica podemos classificar as reações em quatro tipos diferentes:
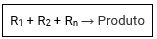
Adição ou síntese
As reações de adição ou síntese são aquelas onde substâncias se juntam formando uma única substância.
Síntese total
Somente substâncias simples no reagente
Ex.: C + O2 → CO2
S + 3/2 O2 + H2O → H2SO4
Síntese parcial
Pelo menos uma substância composta nos reagentes.
Ex.: SO2 + 1/2 O2 → SO3
CaO + H2O → Ca(OH)2
Decomposição ou análise
As reações de decomposição ou análise são aquelas onde uma substância dá origem a duas ou mais substâncias.
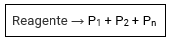
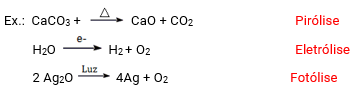
Simples troca ou deslocamento
As reações de simples troca ou deslocamento são aquelas onde existe a substituição do cátion ou do ânion de uma substância por um novo cátion ou ânion derivado de uma substância simples.

Ex.: Deslocamento do cátion:
Ocorre: CuCl2 + Zn → ZnCl2 + Cu
O Zn é mais reativo que o Cu, portanto, consegue substituí-lo no CuCl2.
Não ocorre: KBr + Hg → X
O Hg é menos reativo que o K, portanto, não consegue substituí-lo no KBr.
Tabela de reatividade dos metais:

Deslocamento do ânion:
Ocorre: 2 KBr + Cl2→ 2 KCl + Br2
O Cl é mais reativo que o Br, portanto, consegue substituí-lo no KBr.
Não ocorre: 2NaCl + I2 → X
O I é menos reativo que o Cl, portanto, não consegue substituí-lo no NaCl.
Tabela de reatividade dos ametais:
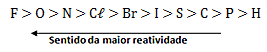
Dupla troca ou permutação
As reações de dupla troca ou permutação são aquelas que ocorrem entre substâncias compostas, havendo uma troca de espécies químicas que resulta na formação de novas substâncias compostas.
Ex.: AgBr + Al+S3 → AlBr3 + Ag2S
O cátion Ag+ do AgBr se liga ao ânion S−2 do Al2S3, e o cátion Al+3 do Al2S3 se liga ao Br- do AgBr.
Obs.: Condições para ocorrência das reações de dupla troca
Formação de eletrólitos fracos
Na2S + H2SO4 → H2S (eletrólito fraco) + Na2SO4
Formação de gás
CaCO3 + HCl → H2O + CO2(gás) + CaCl2
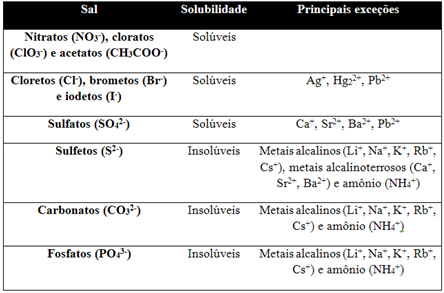
Formação de precipitado
AgNO3 + NaCl → AgCl(precipitado - sólido) + NaNO3
Tabela de solubilidade