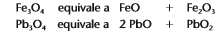Reações com Óxidos: Óxido básico mais água → Base
Óxido ácido mais água → Ácido
Óxido básico mais ácido → Sal mais água
Óxido ácido mais base → Sal mais água
Óxido ácido mais óxido básico → Sal
Reações com Óxidos anfóteros: sal mais água
Complementando a reação com óxido I
Complementando a reação com óxido II
Óxidos são compostos binários (2 elementos) nos quais o oxigênio é o elemento mais eletronegativo.
Por exemplo: H2O, CO2 , Fe2O3 , SO2 , P2O5 etc.
Existem compostos binários com oxigênio onde ele não é o mais eletronegativo, então não pode ser considerado um óxido, são eles:
OF2 e O2F2 que são considerados sais, pois nesse caso o flúor é o elemento mais eletronegativo, saindo assim da definição de óxidos.
Óxidos básicos: São óxidos que reagem com a água, produzindo uma base, ou reagem com um ácido, produzindo sal e água, geralmente óxidos onde o metal tem nox +1,+2 ou +3.
Exemplo:
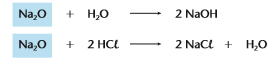
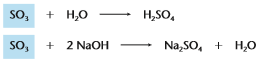
Óxidos ácidos ou anidridos: São óxidos que reagem com a água, produzindo um ácido, ou reagem com uma base, produzindo sal e água, onde o nox do metal (nox possíveis: +5, +6 ou + 7) ou com qualquer ametal (excluindo os ametais dos óxidos neutros).
Exemplo:
O nome anidrido vem do fato desse tipo de óxido ter a capacidade absorver água e forma seu respectivo ácido.
Exemplo: SO3 + H2O → H2SO4
Anidrido sulfúrico, óxido de enxofre IV ou trióxido de enxofre + água → Ácido sulfúrico
Óxidos anfóteros: Podem se comportar ora como óxido básico, ora como óxido ácido, onde o metal pode ter nox +3 ou +4(exceção do Zn,Pb,Sn) ou o oxigênio estar ligado a um ametal(excluindo os ametais dos óxidos neutros).
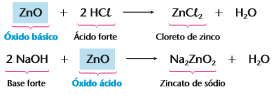
Os óxidos anfóteros são, em geral, sólidos, iônicos, insolúveis na água. Os mais vistos em provas ou vestibulares são:
ZnO; Al2O3; SnO ; SnO2 ; PbO ; PbO2; As2O3; As2O5; Sb2O3 e Sb2O5
Óxidos neutros: São óxidos que não reagem com água, nem com ácidos nem com bases. Existem muito poucos óxidos com essa classificação, os exemplos mais comuns são:
CO - monóxido de carbono
N2O -óxido nitroso
NO - óxido nítrico
Obs: Muitos autores consideram a água(H2O) um óxido neutro.
Óxidos duplos, mistos ou salinos: São óxidos que se comportam como se fossem formados por dois outros óxidos, do mesmo elemento químico, onde seu nox equivale a 8/3.
Exemplo: