Partículas radioativas
Reações de decaimento e bombardeamento
Cinética radioativa
A radioatividade, que hoje conhecemos e utilizamos, estuda a emissão de radiações do núcleo instável de um átomo. Ou seja, átomos de alguns elementos – especialmente os que possuem massa muito grande – se desintegram espontaneamente, perdem/liberam partículas presentes em seus núcleos (partículas nucleares) ou ondas eletromagnéticas, para obterem estabilidade. Isso significa que tais átomos têm atividade radioativa.
Mas como toda ciência, o estudo das radiações evoluiu ao longo do tempo, até chegar ao conhecimento atual. Vamos resumir essa história?
I. Histórico
- Antoine-Henri Becquerel: físico francês que trabalhava com sais de urânio, percebeu que um desses sais, o sulfato duplo de potássio e uranila – K2(UO2)(SO4)2 – era capaz de impressionar filmes fotográficos. Estudou-se tal comportamento e viu-se que isso se devia a radiações emitidas pelo sal.
- Wilhelm Conrad Roentgen: físico alemão que trabalhava com raios catódicos (do tubo de Crookie), percebeu que esses raios emitiam uma nova radiação – os raios X – quando em contato com vidro ou metal. Posteriormente, viu-se que ela não possui massa nem carga.
- Marie Sklodowska Curie: física e química polonesa que também trabalhava com sais de urânio, percebeu que impressões fotográficas feitas por esses sais aumentavam de intensidade à medida que aumentava-se a quantidade desses sais. Concluiu, assim, que a intensidade de radiação é proporcional à quantidade de urânio e, portanto, a radioatividade era um fenômeno atômico.
- Ernest Rutherford: físico neozelandês que trabalhou com polônio, estudou a ação de campos eletromagnéticos sobre as radiações e, assim, descobriu os raios α (alfa), β (beta) e γ (gama). Veremos com detalhes a seguir.
II. Experimento de Rutherford
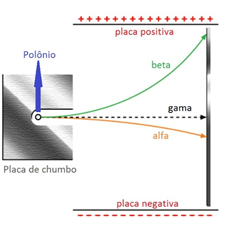
Criou uma aparelhagem contendo: polônio (elemento com atividade radioativa) em um bloco de chumbo, campo magnético, placas carregadas eletricamente (uma positiva e uma negativa) e uma placa fluorescente com sulfeto de zinco, que emite luminosidade ao ser atingida por radiação.
- β - como é desviada em direção à placa positiva, concluiu-se que possui carga negativa;
como sofreu desvio com facilidade (desvio grande), concluiu-se que possui massa pequena. - γ - como não sofre desvio, concluiu-se que não possui carga;
não possui massa; - α - como é desviada em direção à placa negativa, concluiu-se que possui carga positiva;
como sofreu desvio com dificuldade (desvio pequeno), concluiu-se que possui massa maior.
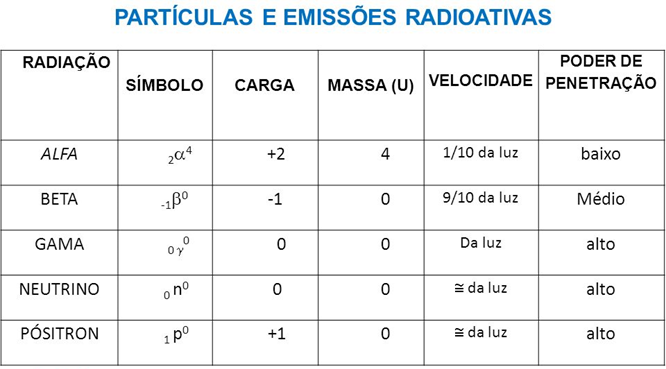
III. Radiações
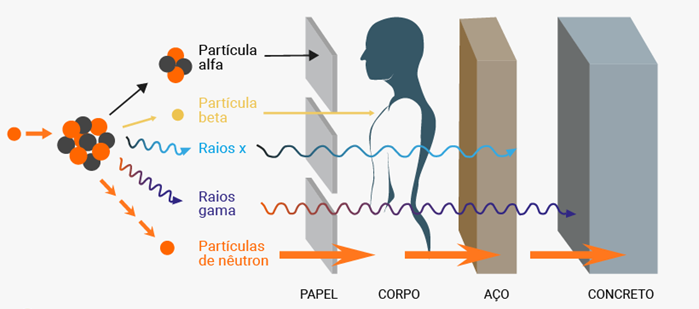
IV. Leis da radioatividade
- 1ª Lei da Radioatividade ou Lei de Soddy: emissão de partículas α
O núcleo de um elemento radioativo, ao emitir uma partícula α, origina um elemento com número atômico menor em 2 unidades e número de massa menor em 4 unidades.
Mas por quê? Porque como “na natureza nada se cria, nada se perde, tudo se transforma”, a soma dos números atômicos (número de prótons) de antes da seta da reação nuclear deve ser igual à soma dos números atômicos de depois da seta. O mesmo deve ocorre com o número de massa.
Z antes = Z depois / ZP = ZR
A antes = A depois / AP = AR
IMPORTANTE À BEÇA: em uma reação nuclear, são representados os nuclídeos dos átomos envolvidos.
OPA, nuclídeo?
É a representação do núcleo de um átomo, e sua notação se faz com o símbolo do elemento mais seu número atômico e seu número de massa, geralmente.
Exemplo: se for representado o nuclídeo do oxigênio-16 (isótopo do oxigênio de número de massa 16), será assim: 8O16.
- 2ª Lei da Radioatividade ou Lei de Soddy-Fajans-Russel: emissão de partículas β
O núcleo de um elemento radioativo, ao emitir uma partícula β, origina um elemento com número atômico maior em 1 unidade e número de massa igual ao do elemento desintegrado.
O motivo é o mesmo da primeira Lei.
V. Cinética Radioativa
Como toda “cinética”, ela estuda velocidade. Já que é “radioativa”, estuda a velocidade da desintegração de núcleos, ou o tempo necessário para que o núcleo de um elemento emita certa quantidade de radiação.
• Tempo de meia-vida (T½ /P)
É o tempo em que uma amostra de átomos de um elemento radioativo tem sua quantidade reduzida à metade, como diz o nome. Cada elemento possui seu tempo de meia-vida específico.
Exemplo: O tempo de meia vida do fósforo-32 é de 32 dias. Isso significa que uma amostra contendo 1 mol (6,02.1023 átomos/32 g) desse elemento hoje terá ½ mol (3,01.1023 átomos/16 g) dele daqui a 32 dias.
Logo, daqui a 128 dias (4 x 32), a sua quantidade será a inicial dividida por 2, depois por 2 de novo, depois por mais 2 e por fim, por mais 2.
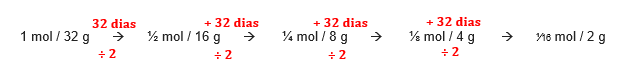
Sendo assim, quantidade final (Qf) será igual a quantidade inicial (Qi)/2/2/2/2 ou Qi/24. Dessa resolução, tiramos a fórmula:
Qf = Qi /2P
Onde:
Qf e Qi = pode ser mf e mi, se a quantidade for em massa; nf e ni, se for em número de mols, e por aí vai;
P = é o período de meia-vida do elemento em questão.
VI. Transmutação artificial
Chamamos de transmutação nuclear o bombardeamento de um nuclídeo com alguma partícula, formando um novo elemento químico e, geralmente, outras partículas são liberadas. Dizemos que é artificial porque não ocorre de forma espontânea, natural, há a intervenção humana.
Exemplo: No bombardeamento do nitrogênio-14 com partículas alfa, há a agregação da mesma a esse elemento e a liberação de um próton, gerando oxigênio-17 (Z=8).
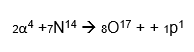
VII. Fissão nuclear
Caso a transmutação rompa o nuclídeo bombardeado, gerando nuclídeos de elementos diferentes de números atômicos menores e complementares ao do primeiro (ou seja, Z2+Z3=Z1, sendo Z1 o número atômico do nuclídeo bombardeado e Z2 e Z3 os dos elements resultantes), houve uma fissão nuclear. Fissão porque o elemento foi fissonado/dividido em outros.
Exemplo: No bombardeamento do urânio-235 com nêutrons, como ocorre na bomba nuclear, há a fissão do urânio, liberando bário e criptônio e mais três nêutrons.
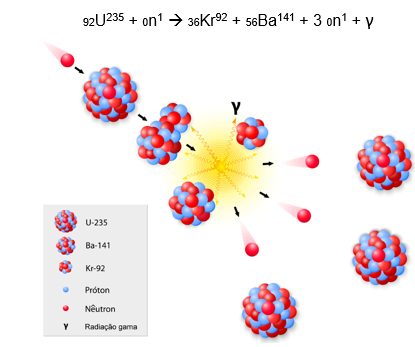
Na bomba nuclear, cada nêutron formado bombardeia mais um átomo de urânio-235, liberando mais bário, criptônio e mais 3 nêutrons, que bombardeiam mais 3 átomos de urânio, e assim sucessivamente. A isso, damos o nome de reação em cadeia.
A fissão de um átomo de urânio-235 já libera muita energia, em forma de calor. Sendo alguns quilos desse elemento, a quantidade de energia liberada é absurdamente maior, o que faz da bomba nuclear um material bélico de altíssimo potencial de destruição, muito superior à de uma bomba de TNT, por exemplo.
A fissão nuclear também ocorre em uma usina nuclear, em que se faz a quebra do urânio, liberando muita energia, que aquece a água, fazendo-a vaporizar e girar uma turbina, a qual resulta em produção de energia elétrica.
VIII. Fusão nuclear
Como o próprio nome explica, consiste na fusão dos núcleos de elementos, formando outro elemento e liberando partículas e energia. No Sol, por exemplo, ocorre a reação de fusão de dois núcleos de hidrogênio, gerando hélio, um neutron e muita energia, em forma de calor.
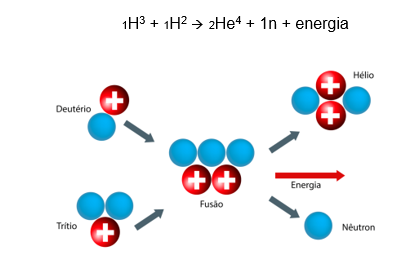
Na bomba de hidrogênio, ou bomba H, ocorre a mesma reação, por isso é um material bélico tão preocupante para a humanidade. A energia térmica liberada é muito superior à de uma bomba atômica.
IMPORTANTE À BEÇA:
A arqueologia e outros ramos do estudo da história natural utilizam o método de datação de fósseis com carbono-14. Trata-se de um isótopo do carbono com número de massa igual a 14 (6 prótons e 8 nêutrons) que tem núcleo instável, e por isso tem atividade radioativa.
- A frequência desse isótopo na natureza é conhecida pelos cientistas, ou seja, a proporção entre a quantidade de carbono-12 (C-12, o mais estável e mais presente na natureza) e de carbono-14 (C-14) incorporados aos organismos vivos e aos compostos químicos espalhados pelo ambiente já foi calculada.
- Além disso, conhece-se a meia-vida do C-14, que é de aproximadamente 5600 anos. Então, é possível datar um fóssil, isto é, calcular em qual data ele viveu.
- Mas como? Vamos supor que a proporção de C-12 e C-14 no ambiente seja de 1000:1, respectivamente. Se um cadáver possuir 1000 mols de C-12, vai possuir 1 mol de C-14, caso tenha morrido há pouco tempo e ainda não tenha havido decaimento dele. Então, se nesse cadáver encontramos apenas 0,5 mol de C-14 (metade da quantidade inicial do elemento), sabemos que já se passaram 5600 anos desde que o organismo morreu e parou de incorporar matéria orgânica.
- Quanto menos C-14 no fóssil, mais antigo ele é.
OBS: O exemplo acima (proporção 1000:1) foi apenas suposição, a concentração real de C-14 na Terra é de 10 ppb (10 átomos de C-14 por bilhão de átomos na natureza).