Propriedades Aperiódicas
Raio Atômico
Análise gráfica do raio atômico
Raio iônico
Eletronegatividade e eletropositividade
Energia de ionização e afinidade eletrônica
Propriedade periódicas são aquelas que de acordo com o aumento do número atômico os valores aumentam ou diminuem de forma regular ao longo dos períodos e grupos da tabela periódica.
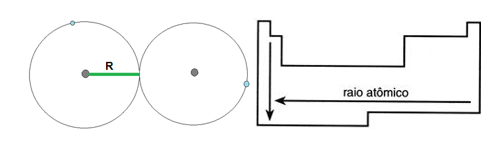
Raio atômico
O raio atômico também pode ser chamado de tamanho do átomo, é a metade da distância entre o núcleo de dois átomos isótopos. Com isso pode-se dizer que o raio atômico é a distância do núcleo até o seu elétron mais externo.
Analisando a tabela periódica podemos dizer que o tamanho do raio atômico cresce com o aumento do número de camadas (crescendo para baixo) e com a diminuição do seu número atômico (crescendo para a esquerda).
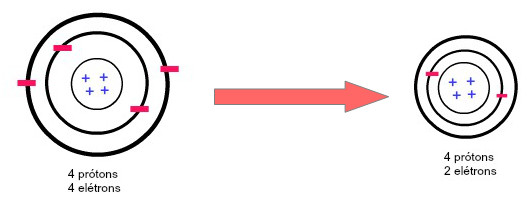
Obs.: o raio de um cátion é menor que o raio de seu átomo, no nosso exemplo abaixo é possível visualizar isto por conta da redução do número de camadas eletrônicas.
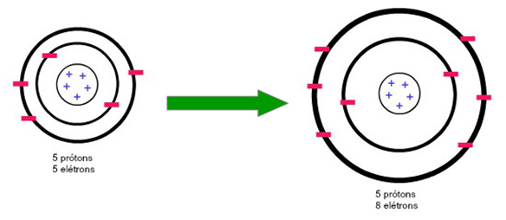
o raio de um ânion é maior que o raio de seu átomo, pois há mais elétrons se repelindo, necessitando um maior espaçamento entre eles.
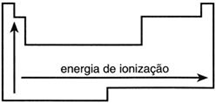
Energia de Ionização ou Potencial de ionização (E.I.)
É a energia mínima necessária para que um átomo isolado, e no estado gasoso, perca um elétron e se transforme em um cátion.
Analisando a tabela periódica podemos dizer que a energia de ionização cresce com a diminuição do número de camadas, pois haverá assim uma menor distância e maior atração entre prótons e elétrons (crescendo para cima) e com o aumento do seu número atômico (crescendo para a direita).
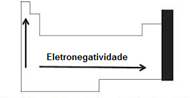
Eletronegatividade
É a energia necessária para a entrada de um elétron num átomo isolado. Quanto maior a afinidade eletrônica, maior é a capacidade do átomo de receber elétron.
Analisando a tabela periódica podemos dizer que a eletronegatividade cresce com a diminuição do período, pois haverá assim uma menor distância e maior atração entre prótons e elétrons (crescendo para cima) e com o aumento do seu número atômico (crescendo para a direita).
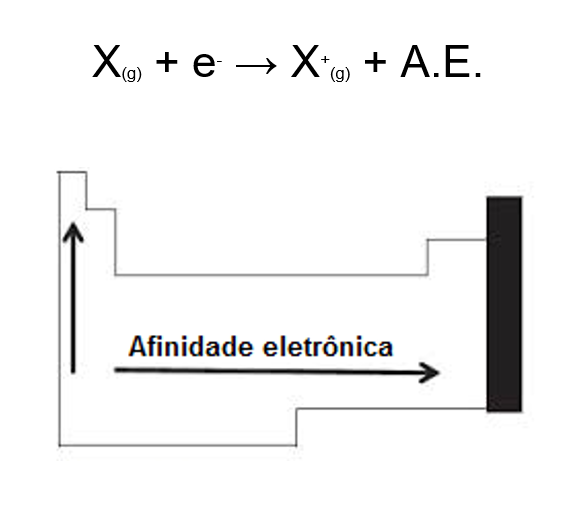
Afinidade eletrônica ou eletroafinidade (A.E.)
É a quantidade de energia liberada quando um átomo isolado, e no estado gasoso, ganha um elétron e se transforme em um ânion.
Analisando a tabela periódica podemos dizer que a afinidade eletrônica cresce com a diminuição do período, pois haverá assim uma menor distância e maior atração entre prótons e elétrons (crescendo para cima) e com o aumento do seu número atômico (crescendo para a direita).
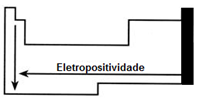
Eletropositividade ou caráter metálico
É a capacidade que um átomo apresenta de ceder elétrons em uma ligação química. Está propriedade reflete a capacidade contrária a da eletronegatividade.
- Propriedade aperiódicas são aquelas que de acordo com o aumento do número atômico não possuem regularidade ao longo dos períodos e grupos da tabela periódica.
Massa atômica (A)
A massa atômica é dada pelo somatório do número atômico (Z) e nêutrons (n). A massa cresce no mesmo sentido do número atômico, para direita e para baixo.
A = Z + n
Calor específico ( c )
O calor específico é dado por:
c = Q/m(Tf-To)
Portanto, crescimento é inverso ao número atômico (que é proporcional à massa): para a esquerda e para cima.