Densidade de um gás e equação de estado
Calculando a densidade de um gás
Densidade de um gás nas CNTP
Densidade relativa
Relacionando com a densidade do ar
Densidade
Densidade é uma relação entre a massa e o volume de uma material para uma dada temperatura e pressão.

A densidade pode ser escrita em qualquer unidade de massa para qualquer unidade de volume. Mas geralmente nós iremos treabalhar com a densidades nas seguintes unidades:
- g/mL
- g/cm3
- kg/L
- kg/m3
OBS: a densidade pode ser calculada para qualquer estado físico da matéria (sólido, líquido ou gasoso)
Pensando mais para gases que é o nosso foco nesse aula. Vamos lembrar da equação de clayperon, equação usada apenas para um gás:
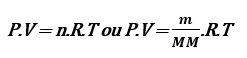
P = Pressão
V = Volume
n = Número de mols
R = Constante dos gases
MM = Massa molar
T = Temperatura em kelvin
Isolando a massa e o volume nós temos:
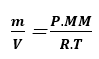
Substituindo a fórmula de densidade nessa fórmula nós temos:
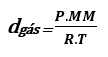
Importante!
Essa relação só pode ser usada para gases.
Com essa relação nós podemos compreender porque o balão de ar quente sobre quando é ligado a chama que aquece o ar dentro do balão.

Analisando a fórmula, d gas = (P.MM)/(R.T), a medida que a temperatura aumenta, a densidade diminui, elas são inversamente proporcionais. Por isso que ao aquecer o gás dentro do balão, como sua densidade fica menor, ele começa a subir.
Exemplo:
Determina a densidade do CO2 a uma pressão de 2,24 atm e uma temperatura de 546 K?
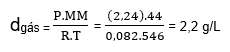
Densidade de uma gás nas CNTP
CNTP --> Temperatura = 0 °C e Pressão = 1 atm
Aplicando na fórmula de densidade de um gás:
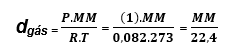
Concluímos então, que nas CNTP:
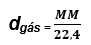
Exemplo:
Qual a densidade do oxigênio nas CNTP?
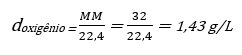
Densidade relativa
Densidade relativa vai ser pra gente a densidade de um gás em relação a outro gás. Basicamente nós iremos comparar a densidade de diferentes gases.
Vamos generalizar comparando um gás hipotético A com um gás hipotético B. Relacionando a densidade de A com a densidade de B, nós teremos:
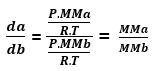
Exemplo:
Quantas vezes o oxigênio e mais denso que o hidrogênio?
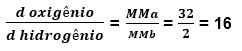
Podemos concluir então que a densidade do oxigênio é 16 vezes maior que a densidade do hidrogênio
OBS: Como nós estamos comparando as densidades, a unidade da densidade de um gás irá cancelar a unidade do outro gás, sendo assim, a resposta será sempre adimensional, sem unidade.
Relacionando com a densidade do ar
Aqui nós iremos aplicar a fórmula vista anteriormente em densidade relativa. Agora iremos comparar qualquer gás com o ar atmosférico. Essa analise é muito interessante, pois através dela nós podemos dizer por exemplo se uma bexiga com determinado gás sobe ou desce.
OBS: O ar atmosférico é uma mistura gasosa, sendo assim, a massa molar que nós iremos usar será uma média de todos os gases que a compõem.
MM ar = 28,9 g/mol
Comparando o gás hélio com o ar.
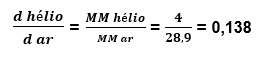
Como esse valor é menor que 1, esse gás é menos denso que o ar atmosférico, sendo assim, uma bexiga com gás hélio sobe.
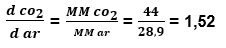
Como esse valor é maior que 1, esse gás é mais denso que o ar atmosférico, sendo assim, uma bexiga com CO_22 desce.