Fração molar
Aplicando o conceito de fração molar e pressão parcial
Determinando a fração molar de cada gás na mistura
Determinando as pressões parciais
Exercício de aula 3 sobre mistura gasosa
O estado gasoso: as misturas gasosas-pressão parcial
Quando nós misturamos dois gases em um único recipiente, nós podemos analisar a pressão total e também a pressão parcial, que seria a pressão que cada um dos gases está causando. Para entender esse conceito, é preciso lembrar de fração molar. Pois a mesma ideia usada para a relação em número de mols, será usada para a relação em função das pressões.
Fração molar
Fração molar é calculada pelo número de mols de uma substância sobre o número de mols totais.
Xi = ni/nt
Importante!
Número de mols totais (nt) é igual a soma do número de mols de todos todos os participantes da mistura.
nt = n1 + n2 + n3 + ...
OBS: Fração molar é adimensional, ou seja, não possui unidade.
Pressão parcial
Além de chegarmos na fração molar a partir do número de mols, nós podemos fazer a relação com as pressões parciais. A ideia é a mesma, porém nós iremos substituir número de mol por pressão parcial.
Xa = Pa/Pt
Pressão total é igual a soma das pressões parciais da mistura.
Volume parcial
O volume parcial de um gás será o volume que um gás da mistura ocupariá se estivesse sozinhos nas mesma condições de pressão e temperatura da mistura.
Veja um exemplo para ficar mais claro
Considere dois balões contendo quantidades quaisquer de dois gases diferentes na mesma temperatura.

Cada balão irá possuir uma certa quantidade de gás. Nós podemos afirmar que quanto maior for essa quantidade, maior o volume do balão. Pense numa bexiga, quanto mais ar nós colocarmos lá dentro, maior será a bexiga, maior será o seu volume.
Imagine agora que nós iremos juntar esses dois balões em um único balão. De maneira que nenhum gás seja perdido. Vamos imaginar que nós conseguimos transferir todo o conteúdo do balão A e do balão B para um novo balão.
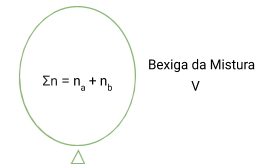
Podemos concordar que esse novo volume (da mistura gasosa) é maior do que o volume de Va e Vb, porque agora nós temos uma quantidade maior de gás.