Introdução
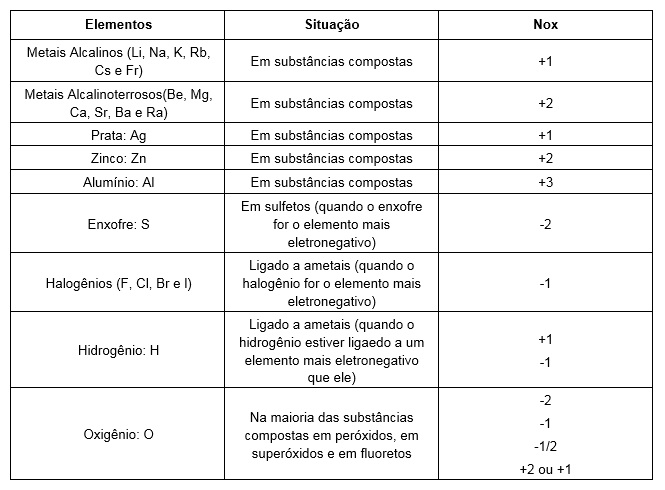
Elementos de nox fixo
Elementos de nox variável
Regras para determinação do nox
Nox em compostos orgânicos
Número de oxidação (nox)
O NOX é a carga que um elemento adquire depois de realizar qualquer tipo de ligação para atingir a estabilidade (regra do octeto) ou de se manter no seu estado fundamental.Em compostos iônicos, número de oxidação (Nox) é a própria carga elétrica do íon, ou seja, o número de elétrons que o átomo perdeu ou ganhou. No caso dos compostos covalentes, por não ter perda ou ganho de elétrons, pode estender o conceito de número de oxidação, dizendo que seria a carga elétrica teórica que o átomo iria adquirir se houvesse quebra da ligação covalente, ficando os elétrons com o átomo mais eletronegativo. Para calcularmos o nox dos elementos de uma substância devemos igualar a soma das cargas à 0. Caso seja um íon devemos igualar a soma dos nox a carga do íon. E em substâncias simples o nox é sempre igual a 0.
Exemplos:
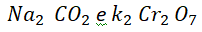
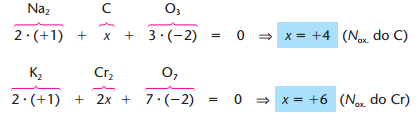
Ou exemplo no caso dos íons
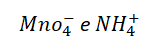
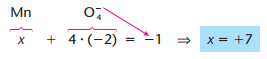
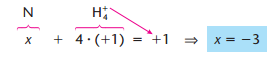
Como nos sabíamos que o nox do Na era +1? Isso foi possível devido a algumas regras. Temos alguns elementos que apresentam nox fixo. Na tabela a baixo, temos uma lista com esses elementos.
Elementos com número de oxidação fixo:
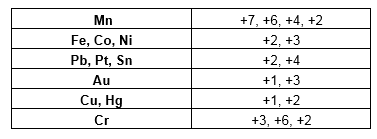
Nox variável
Alguns elementos de transição (família B) tem nox variável, ou seja, depende com quem ele está ligado, a seguir temos uma lista dos mais comuns:
Número de oxidação compostos orgânicos
Nesse caso, nós iremos olhar para da ligação. O elemento que for mais eletronegativo recebera a carga -1 o e menos eletronegativo, a carga +1. Caso os elementos sejam iguais, a carga será zero. No caso das ligações duplas e triplas, devemos colocar -1 ou +1, para cada ligação.
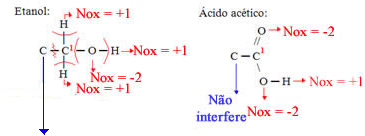
Etanol
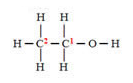
Ácido acético
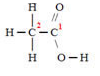
Vamos considerar cada carbono separadamente. Primeiro o carbono 1:
Não há diferença de eletronegatividade, porque é uma ligação entre dois carbonos, portanto, nenhum deles ganha ou perde elétrons nessa ligação e não há interferência no Nox do carbono 1.
Considerando as perdas e ganhos de elétrons do carbono 1, temos:
Etanol:
Ganhos: 3eletrons de cada hidrogênio;
Perdas: 2 elétrons para cada oxigênio;
Total: Ficou com 1 elétrons a mais, assim, seu Nox = - 1
Ácido acético:
Ganhos: 1 elétrons de cada hidrogênio;
Perdas: 4 elétrons para cada oxigênio;
Total: Ficou com 3 elétrons a menos, assim, seu Nox = +3
Agora vamos considerar o Nox do carbono 2,que é o mesmo tanto no etanol quanto no ácido acético:
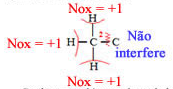
Ganhos: 3 elétrons de cada hidrogênio;
Perdas: Nenhuma;
Total: Ficou com 3 elétrons a mais, assim, seu Nox = -3