Mistura de soluções com o mesmo soluto
Cálculo da Concentração Final
Molaridade e Fração Molar
Questão sobre mistura de soluções de KOH
Questão sobre mistura de soluções de HNO3
Questão sobre uma mistura de soluções de NaOH
Misturas de soluções de uma mesmo soluto
Vamos imaginar duas soluções (A e B) de cloreto de sódio (NaCl), como ilustrado abaixo. Na solução final (A + B), a massa do soluto é igual à soma das massas dos solutos em A e B.
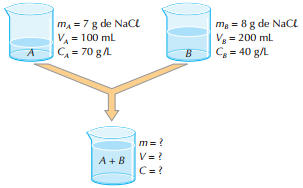
Portanto: m = 7 + 8 ⇒ m = 15 g de NaCl
O volume da solução também é igual à soma dos volumes das soluções A e B. Portanto:
V = 100 + 200 ⇒ V = 300 mL de solução Com esses valores e lembrando a definição de concentração, obtemos, para a solução final (A + B):
300 mL de solução ---------- 15 g de NaCl
1.000 mL de solução -------- C
Cfinal = 50 g/L
ou
C = m/V = 15 g/0,3L = 50 g/L
Obs: É interessante notar que a concentração final (50 g/L) terá sempre um valor compreendido entre as concentrações iniciais (70 g/L > 50 g/L > 40 g/L).
podemos generalizar esse tipo de problema, da seguinte maneira:
• massa do soluto na solução A: ma = Ca.Va
• massa do soluto na solução B: mb = Cb.Vb
• massa do soluto na solução final: m = CV
Como as massas dos solutos se somam (m = ma + mb ), temos:
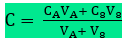
Exemplo:
200 mL de uma solução a 0,2 mol.L-1 de KBr é misturada a 100mL de uma solução de mesmo soluto com concentração igual a 0,4 mol.L-1. Qual a concentração da mistura obtida?
Solução 1
V = 200 mL
M = 0,2 mol.L-1
Solução 2
V = 100 mL
M = 0,4 mol.L-1
Solução final
Vf = V1 + V2
Vf = 200 + 100
Vf = 300 mL
M1 . V1 + M2 . V2 = Mf . Vf
0,2 . 200 + 0,4 . 100 = Mf . 300
Mf = 0,27 mol.L-1 de KBr.
Unidades de concentração
Concentração comum ( C )
Essa concentração é uma das mais usadas. Ela relaciona a quantidade de massa do soluto (m1)presente em um determinado volume de solução (V).
Trazendo para uma fórmula matemática:
C = m1/V
Unidades:
C -> g/L
m1 -> g
V -> L
Concentração molar (M)
Nessa unidade de concentração, ao invés de relacionarmos a massa com o volume, vamos relacionar a quantidade de matéria do soluto (n1) com o volume da solução (V).
Trazendo para uma fórmula matemática:
M= n1/V
Unidades:
M -> mol/L
n1 -> mol
V -> L
Importante!!!
É possível escrever essa fórmula um pouco diferente. Sabemos que o número de mols (n1) é dado pela seguinte fórmula:
n1 = m1/MM1
Substituindo n1 na fórmula de molaridade, temos:
M = m1/(MM1.V)
Porcentagem em massa (%m/m)
Essa unidade de concentração irá relacionar a quantidade em massa de soluto (m1) que está contida em 100 g de solução.
Trazendo para uma fórmula matemática:
% m/m= m1/m x 100%
Porcentagem por volume (%V/V)
Essa unidade de concentração irá relacionar a quantidade por volume de soluto (V1) que está contida em 100 mL de solução.
Trazendo para uma fórmula matemática:
% V/V= V1/V x 100%
Porcentagem em massa por volume (%m/V)
Essa unidade de concentração irá relacionar a quantidade em massa de soluto (m1) que está contida em 100 mL de solução.
Trazendo para uma fórmula matemática:
% m/V= m1/V x 100%
Fração molar (X)
Essa unidade irá relacionar o número de mols de alguma espécie (ni) sobre o número de mols totais (nt).
Trazendo densidade para uma fórmula matemática:
Xi= xi/xt
Unidades:
X -> adimensional (sem unidade)
ni -> mol
nt -> mol
nt = n1 + n2
Dependendo de qual espécie o problema estiver perguntando, nós iremos escrever a fração molar em função de diferentes participantes.
Exemplo: Uma mistura de 2 mol de NaCl com 8 mol de H2O.
Primeira coisa é saber o número de mols totais -> nt = n1 + n2 -> nt = 2 + 8 -> nt = 10 mol
Fração molar do soluto (NaCl):
X1 = n1/nt = 2/10 = 0,2
Fração molar do solvente (NaCl):
X2 = n2/nt = 8/10 = 0,8
Importante!!!
A soma das frações molares deve ser sempre igual a 1.
Molalidade (W)
Essa unidade aparece bem pouco. Mas é importante termos conhecimento dela. Ela relaciona a quantidade de matéria do soluto (n1) presente em uma massa de solvente (m2), expressa em Kg.
Trazendo densidade para uma fórmula matemática:
W= n1/m2
Unidades:
W -> mol/Kg
n1 -> mol
m2 -> Kg