Atingindo a estabilidade: teoria do octeto
Introdução à ligação iônica
Montando um composto iônico
Generalizando a fórmula
Propriedade dos compostos iônicos
Ligação metálica
Propriedades dos compostos metálicos
Teoria do Octeto
Os átomos não ficam ‘sozinhos’ na natureza, mas ligados, porque não são estáveis. Tal instabilidade, com exceção de um grupo de elementos, é fruto da configuração eletrônica incompleta da maioria dos elementos químicos.
É uma observação da natureza que os chamados gases nobres não costumam se ligar a outros elementos. Eles ‘preferem’ ficar ‘sozinhos’ ou seja, são encontrados não ligados, na forma de Ne, Xe, He. Tais elementos apresentam suas últimas camadas, as de valência, completas, com oito elétrons. Associou-se, portanto, a completude da última camada à estabilidade dos átomos.

Conectando-se os pontos, chegamos ao comportamento geral, com exceções, dos elementos na natureza. Eles tendem a se ligar para completar suas camadas de valência. Em geral, tendem a atingir oito elétrons na última camada. Eis a teoria do octeto.
Obs.: É válido ressaltar que H e He têm apenas uma camada eletrônica em seus átomos. Dessa forma, o máximo de elétrons possíveis é 2. Logo, estes elementos se estabilizam com 2 elétrons na última camada.
Eletronegatividade: é a tendência, de um núcleo, de atrair os elétrons em uma ligação química.
Ligação iônica ou eletrovalente
Na ligação iônica, os elétrons são transferidos de um átomo com tendência a doar (metais) para um átomo com tendência a perder elétrons (ametais ou hidrogênio). Após a transferência, formam-se íons e estes se ligam por força eletrostática.
A diferença de eletronegatividade é, em geral, maior que 1,7 em ligações iônicas.
Exemplos:
Na e Cl

Para completar o octeto, o melhor para o sódio seria perder um elétron. O cloro, idealmente, ganharia um elétron para completar seu octeto.
Mg e Cl
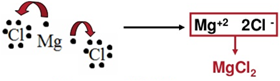
Para cada magnésio, precisa-se de dois átomos de cloro para todos terem seus octetos completos.
MgCl2 (fórmula molecular); Mg2+ e Cl-1 (fórmula iônica, mostram-se as cargas)
Como montar a fórmula molecular de um composto iônico?
A partir dos íons formadores, o valor numérico do nox do cátion, em módulo, se torna o índice do ânion e o mesmo acontece com o nox do ânion, que vira índice do cátion. É mais fácil ver pelos exemplos abaixo. Tente perceber a regra.
Al3+ e Cl- formam AlCl3
Ba2+ e Br- formam BaBr2
Li+ e S2- formam Li2S
Na+ e N3- formam Na3N
Principais características
• Átomos dispostos em uma estrutura chamada retículo cristalino;
• Sólidos em temperatura ambiente;
• Apresentam elevada dureza;
• Apresentam baixa tenacidade;
• Possuem elevados pontos de fusão e ebulição;
• Conduzem corrente elétrica quando em solução;
• Conduzem energia elétrica nos estados líquido e gasoso.
Ligação metálica
Ocorre entre metais: Na e Na; Fe e Fe; Al e Al; ligas metálicas de Cu e Au.
Em materiais com este tipo de ligação, os elétrons se movem livremente (“mar de elétrons”) pelos átomos de metal da estrutura. Este é o motivo da alta condutividade dos metais e da sua aplicabilidade em circuitos elétricos.
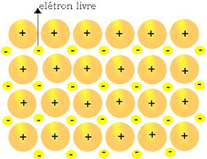
Propriedades dos metais: Pontos de fusão e ebulição elevados, com exceção do mercúrio. Bons condutores térmicos e de eletricidade nos estados sólido e liquido, maleáveis e possuem brilho.
Ligas metálicas são formadas por dois ou mais metais ou um metal com um ametal em quantidade pequena.
Veja algumas ligas metálicas comuns:
Aço: Fe e C
Aço inox: Fe + C + Ni + Cr
Bronze: Cu + Sn
Latão: Cu + Zn
Ouro: Au + Ag ou Au + Cu
Principais características
• a maioria é sólida na temperatura ambiente, com exceção do mercúrio (Hg);
• possuem altas temperaturas de fusão e ebulição;
• conduzem eletricidade (elétrons livres);
• são insolúveis em água;
• possuem brilho, são maleáveis e dúcteis.