Características
Ligação covalente simples
Ligação covalente dativa
Ligação covalente em moléculas ternárias
Exceções à regra do octeto
Propriedades dos compostos moleculares
Ligações covalentes na molécula de CO2
Pares de elétrons no íon hidrônio
Ligação covalente
Esse tipo de ligação se dá por compartilhamento de um par de elétrons, sendo um elétron de cada átomo ou os dois elétrons do mesmo átomo. Há formação de moléculas, logo, esta ligação é também chamada de molecular. Ele acontece entre ametais ou entre o hidrogênio e um ametal, e entre hidrogênios. A diferença das eletronegatividades dos átomos envolvidos, geralmente, é menor que 1,7.
Quando a diferença das eletronegatividades dos átomos envolvidos for igual a zero (∆en = 0), dizemos que a ligação covalente tem caráter apolar e quando a diferença das eletronegatividades for diferente de zero (∆en ≠ 0), dizemos que o caráter da ligação covalente é polar.
Exemplo:
O2
Eletronegatividade: O = 3,5
Δen: 3,5 - 3,5 = 0 → ligação covalente apolar
NH3
Eletronegatividades: N = 3,0 H = 2,1
Δen: 3,0- 2,1 = 0,9 → ligação covalente polar
Obs: Quando chamamos de ligação covalente dativa ou coordenada a ligação que ocorre entre um átomo que atinge a estabilidade eletrônica e outro que ainda necessita de dois elétrons para completar sua camada eletrônica, tendo assim os dois elétrons do compartilhamento vindo do mesmo átomo. Podemos representar esses pares de elétrons por uma seta.
Exemplo:
Usando o exemplo SO2, temos:
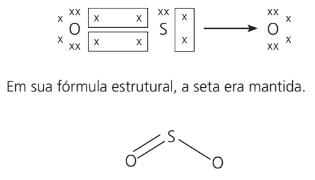
A representação que mostra os elétrons como “x” é chamada de estrutura de Lewis.
Atenção!
Exceções à regra do octeto
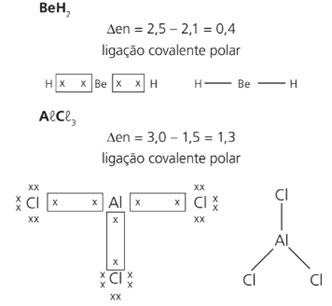
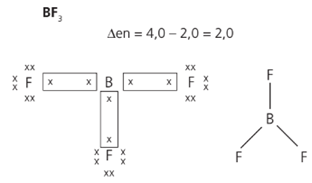
O berílio, o boro e o alumínio formam compostos estáveis com um número de elétrons inferior a 8, desobedecendo assim à regra do octeto.
Embora a diferença de eletronegatividades seja maior que 1,7, no caso do BF3 a ligação não é iônica, pois trata-se da ligação entre ametais; portanto, ligação covalente polar.
Principais características de compostos moleculares
• Pontos de fusão e ebulição baixos.
• à temperatura ambiente podem apresentar-se nos estados: sólido, líquido ou gasoso.
• Não são bons condutores de corrente elétrica em solução aquosa. Porém alguns ácidos fortes, por exemplo, em meio aquoso sofrem ionização (formação de íons), tornando a solução condutora de corrente elétrica.
• Pontos de fusão e de ebulição menores que os dos compostos iônicos (as forças entre moléculas são menores porque não há a atração elétrica provocada pelos íons).
• Pouca solubilidade em água.
• Tendem a ser mais inflamáveis que os compostos iônicos (carbono e hidrogênio queimam facilmente e são encontrados em grande parte dos compostos covalentes).