Isomeria Espacial Geométrica e Óptica
Isomeria Óptica com C. Assimétrico
Estruturas dos Isômeros Ópticos
Cálculo do Número de Isômeros Ópticos
Isomeria Óptica sem C. Assimétrico
Questão sobre Isomeria Espacial
O estudo da isomeria plana esclareceu-nos muito a respeito do motivo pelo qual compostos de mesma fórmula molecular possuem propriedades físicas e químicas diferentes, na medida em que mostrou a diferença entre a estrutura plana da cadeia desses compostos, chamados de isômeros.
No entanto, ficaram mais dúvidas sobre compostos que possuem tanto fórmulas moleculares como fórmulas estruturais planas iguais, contudo apresentam propriedades físicas e químicas diferentes. Assim, descobriu-se a existência de diferenças entre eles que apenas podem ser observadas em dimensões espaciais, e surgiu o que chamamos de isomeria espacial ou estereoisomeria.
Isomeria geométrica
Esse tipo de isomeria se divide entre GEOMÉTRICA ou CIS-TRANS (sobre a qual aprenderemos neste material) e ÓPTICA (a ser vista posteriormente).
A isomeria GEOMÉTRICA ou CIS-TRANS pode ocorrer em 2 tipos de compostos:
Cadeia aberta com ligação dupla:
Condições de ocorrência:
I. Ter ligação dupla na cadeia;
II. Possuir grupos radicais distintos no mesmo carbono da dupla, ou seja, R1 ≠ R2 e R3 ≠ R4.
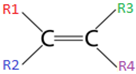
Nestes compostos, a ligação dupla impede a rotação entre os átomos de carbono, que existe quando a ligação entre eles é simples.
Exemplo1:
1,2-dicloroetano \rightarrow→ C_22H_44Cl_22
Ao girarmos um dos carbonos na molécula do 1,2-dicloroetano, a molécula continua a mesma, não altera sua conformação espacial nem suas propriedades.
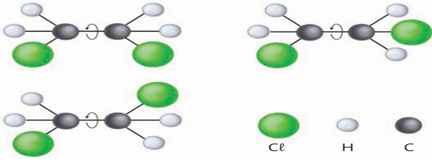
Exemplo 2:
Observe agora a molécula de 1,2-dicloroeteno abaixo:

Como a molécula do 1,2-dicloroeteno não possui essa livre rotação, devido à ligação dupla entre carbonos, motivo pelo qual as 2 estruturas abaixo já representam compostos diferentes, com propriedades físicas e químicas diferentes.
Já que se trata de compostos diferentes, recebem nomes diferentes, da seguinte maneira:
• CIS + nome do composto → quando ligantes iguais estiverem do mesmo lado do plano espacial ou quando o ligante de menor número atômico de um dos carbonos estiver do mesmo lado do plano espacial que o ligante de menor número atômico do outro carbono.
• TRANS + nome do composto → quando ligantes iguais estiverem em lados opostos do plano espacial ou quando o ligante de menor número atômico de um dos carbonos estiver no lado oposto ao do ligante de menor número atômico do outro carbono.
Utilizando o exemplo 2:
cis-1,2-dicloroeteno

Exemplo 3:
Exemplo 4:
Observação: O composto cis é aquele em que os hidrogênios estão para o mesmo lado, formando uma conformação espacial menos simétrica que na trans, em que os hidrogênios estão em lados opostos
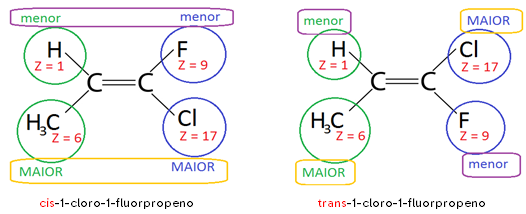
Importante à beça: A isomeria CIS-TRANS foi inicialmente designada para compostos em que R1=R4 e R2=R4 ou R1=R4 e R2=R3. Por isso, estabeleceu-se a ISOMERIA E-Z para indicar os casos em que não há igualdade entre ligantes de um e de outro carbono da dupla, da seguinte maneira:
Z + nome do composto 🡪 quando o ligante de menor número atômico de um dos carbonos estiver do mesmo lado do plano espacial que o ligante de menor número atômico do outro carbono.
E + nome do composto 🡪 quando o ligante de menor número atômico de um dos carbonos estiver no lado oposto ao do ligante de menor número atômico do outro carbono.
Exemplos:
Z-1-cloro-1-fluorpropeno e E-1-cloro-1-fluorpropeno
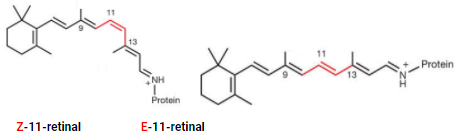
Z-11-retinal e E-11-retinal
No entanto, hoje em dia usamos mais a isomeria CIS-TRANS até mesmo para estes casos, como abordado inicialmente, sendo o isômero Z correspondente ao CIS e o E, ao TRANS.
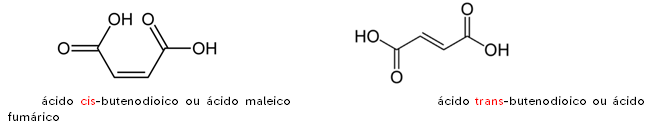
Exemplo:
Cadeia fechada (Isomeria Bayeriana)
Condição de ocorrência
Em pelo menos dois átomos de carbono do ciclo, devemos encontrar dois grupos radicais distintos entre si.
Nestes compostos, o que impede a rotação entre os átomos de carbono é o fato de a cadeia ser fechada.
Exemplo 1:
Já que se trata de compostos diferentes, recebem nomes diferentes, da seguinte maneira:
CIS + nome do composto 🡪 quando ligantes iguais estiverem do mesmo lado do plano;
TRANS + nome do composto 🡪 quando ligantes iguais estiverem em lados opostos do plano espacial.

Exemplo 2:

Importante à beça:
Cis:
Menos estável 🡪 devido à existência de 2 radicais iguais do mesmo lado, seus pares eletrônicos se repelem com maior intensidade. Isso cria um momento dipolar diferente de zero, o que reduz sua estabilidade;
Menos simétrico;
MAIOR ponto de ebulição.
Trans:
Mais estável 🡪 devido à existência de 2 radicais iguais em lados opostos, seus pares eletrônicos se repelem com menor intensidade. Isso cria um momento dipolar igual a zero, o que aumenta sua estabilidade;
Mais simétrico;
MENOR ponto de ebulição.
Isomeria óptica
Existem compostos químicos que apresentam atividade óptica, ou seja, são capazes de desviar o plano da luz polarizada. Vamos entender passo a passo o que isso significa.
A luz que sai direto da fonte luminosa transita em todos os sentidos, ou seja, não possui nenhum pólo específico pelo qual as ondas de luz vibrem. Esta luz, portanto, não é polarizada.
Quando se faz a luz de uma fonte passar por um polarizador, ela passa a irradiar em apenas 1 sentido ou plano, isto é, fica polarizada. Se fizermos esta luz polarizada passar por um composto químico qualquer e, ao medirmos sua polarização com o auxílio de um polarímetro, ela tiver seu plano de irradiação desviado, acusa-se atividade óptica em tal substância.
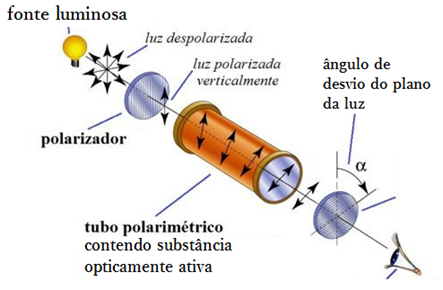
OPA, polarímetro?
Trata-se de um aparelho com função de medir a polarização da luz (se ela é ou não polarizada e em qual plano ela irradia, caso seja). Ele também contém o polarizador, que faz com que a luz passe a ser irradiada em apenas 1 sentido, isto é, polariza-a.
Quando a substância possui atividade óptica:
- Ela possui ISÔMEROS ÓPTICAMENTE ATIVOS: compostos de mesma fórmula molecular, porém com propriedades químicas distintas, pelo fato de terem conformações espaciais diferentes;
- Ela pode desviar o plano da luz para a esquerda – neste caso, chamamo-la de isômero LEVÓGIRO – ou para a direita – isômero DEXTRÓGIRO;
- Ela deve possuir, no mínimo, 1 CARBONO QUIRAL, ou seja, um carbono assimétrico, que faz com que a molécula toda seja assimétrica. É essa assimetria que causa o desvio do plano da luz;
OPA, carbono quiral?
É o carbono que tem todos os grupos ligantes diferentes entre si, o que faz dele assimétrico. A imagem refletida no espelho de qualquer coisa assimétrica não se sobrepõe perfeitamente à coisa real.
Exemplo: Ao colocarmos nossa mão esquerda na frente do espelho, a imagem refletida por ele é idêntica à nossa mão direita, a qual não se sobrepõe com perfeição à outra. Veja:
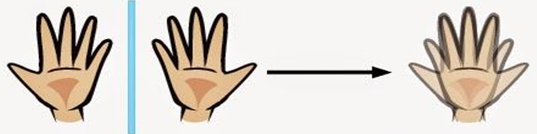
O mesmo ocorre com a molécula assimétrica. Como um dos carbonos é quiral, haverá 2 conformações espaciais diferentes para a mesma estrutura, o que determinará 2 compostos com propriedades diferentes (2 isômeros): 1 conformação espacial e 1 outra exatamente igual à imagem da primeira no espelho, e que não se sobrepõe com perfeição a ela.
Exemplo: O ácido láctico possui 1 carbono quiral.
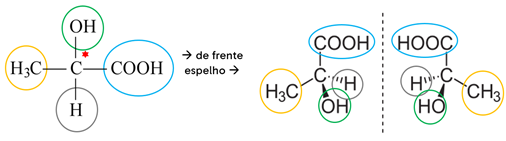
Tentativa de sobreposição dos isômeros:
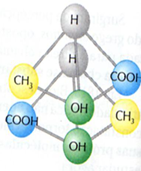
- Cada uma dessas conformações é um isômero do ácido láctico, que desvia a luz polarizada para um lado: esquerdo, no caso do isômero levógiro; e direito, no caso do isômero dextrógiro.
- Não sabemos com certeza qual deles é dextrógiro e qual é levógiro, mas isso não importa tanto, uma vez que sabemos que, se um é o dextrógiro, sua imagem é o levógiro, ou vice-versa.
- Ao par dextrógiro-levógiro, damos o nome de ENANTIÔMEROS.
- Seus isômeros dextrógiro e levógiro desviam a luz com o MESMO ÂNGULO, ainda que para sentidos divergentes;
- A mistura entre quantidades iguais dos dois enantiômeros (mistura equimolar) não é capaz de desviar o plano da luz polarizada, já que cada isômero a desvia com ângulo igual em sentidos opostos (um desvio “anula” o outro). Chamamo-la de MISTURA RACÊMICA ou RACEMATO, e por não apresentar atividade óptica (propriedade diferente dos 2 outros isômeros), dizemos que é o terceiro isômero da estrutura assimétrica (o ISÔMERO OPTICAMENTE INATIVO).
Sendo assim, estruturas com 1 CARBONO QUIRAL possuem 3 isômeros ópticos: 2 IOA (isômeros opticamente ativos) e 1 IOI (isômero opticamente inativo).
E quanto as que possuem mais de 1 carbono quiral? Vejamos.
2 carbonos quirais diferentes
Neste caso:
- CADA CARBONO assimétrico desvia o plano da luz polarizada em 2 SENTIDOS POSSÍVEIS (esquerda ou direita), ou seja, cada carbono pode ter conformação espacial dextrógira ou levógira;
- UM CARBONO desvia a luz com um ÂNGULO (α) e o OUTRO CARBONO desvia com outro ÂNGULO (β), já que os carbonos não são iguais. Logo, o desvio total do plano da luz, ao passar pela substância, será a soma do desvio provocado por cada carbono quiral.
Observe o 2-cloro-3-hidroxibutana:
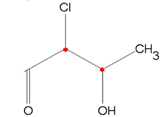
As conformações espaciais possíveis para esta estrutura são:
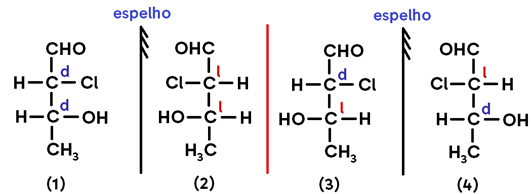
Obs.: A classificação de cada conformação dos carbonos 1 (C1) e 2 (C2) como dextrógiros ou levógiros foi aleatória, já que não temos como saber qual é cada conformação de fato. Mas vamos seguir a explicação tendo essa escolha como base: se na estrutura 1 o C1 está d, sua imagem (estrutura 2) necessariamente é l; se na mesma estrutura o C2 está d, sua imagem (estrutura 2) necessariamente é l. Seguindo esse padrão, conseguimos definir qual tipo de desvio cada carbono das demais estruturas apresenta.
- Os pares 1/2 e 3/4 são pares de ENANTIÔMEROS, uma vez que representam uma estrutura e sua imagem no espelho;
- Já os pares 1/3, 1/4, 2/3 e 2/4, como não são uma imagem do outro, são chamados DIASTEREOISÔMEROS.
Vamos ver como ocorrerão os desvios da luz em cada estrutura (1, 2, 3 e 4). Para tanto, grave que:
- α representa o tamanho do desvio feito pelo carbono quiral 2;
- β representa o tamanho do desvio feito pelo carbono quiral 3;
- o sinal positivo (+) representa o desvio para a direita;
- o sinal negativo (–) representa o desvio para a esquerda;
- o desvio +α anula o –α;
- o desvio +β anula o –β;
- IOA = isômero opticamente ativo;
- IOI = isômero opticamente inativo;
- quando os desvios se anulam, o isômero é opticamente inativo.

Agora vamos ver como ocorrerão os desvios da luz nas misturas equimolares dos pares enantiômeros, as misturas racêmicas.

Assim, concluímos que uma molécula com 2 CARBONOS QUIRAIS possui 4 IOA e 2 IOI.
Generalização: chamando de n o número de carbonos quirais em uma molécula:
- o número de IOA que ela possui é 2^{n};
- o número de IOI que ela possui é 2^{n-1} ou 2^{n}/2.
IMPORTANTE!: 2 carbonos quirais iguais ou isomeria meso
Neste caso:
A molécula possui um PLANO DE SIMETRIA (PS) interno, embora possua carbonos assimétricos;
os 2 carbonos quirais possuem os MESMOS LIGANTES;
CADA CARBONO assimétrico desvia o plano da luz polarizada em 2 SENTIDOS POSSÍVEIS (esquerda ou direita), ou seja, cada carbono pode ter conformação espacial dextrógira ou levógira;
UM CARBONO desvia a luz com um ÂNGULO (α) e o OUTRO CARBONO desvia com o mesmo ÂNGULO (α), já que os carbonos são iguais. Logo, o desvio total do plano da luz, ao passar pela substância, será a soma do desvio provocado por cada carbono quiral.
Observe o 2,3-butanodiol:
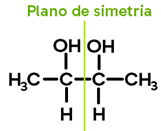
Ligantes do carbono 1:
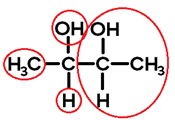
Ligantes do carbono 2:
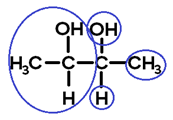
As conformações espaciais possíveis para esta estrutura são:
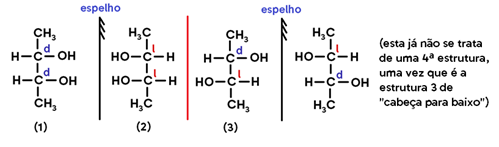
- O par 1/2 é um par de ENANTIÔMEROS, uma vez que representa uma estrutura e sua imagem no espelho;
- Já os pares 1/3 e 2/3, como não são uma imagem do outro, são chamados DIASTEREOISÔMEROS.
Vamos ver como ocorrerão os desvios da luz em cada estrutura (1, 2 e 3). Para tanto, grave que:
- α representa o tamanho do desvio feito tanto pelo carbono quiral 2 como pelo carbono 3;
- o sinal positivo (+) representa o desvio para a direita;
- o sinal negativo (–) representa o desvio para a esquerda;
- o desvio +α anula o –α;
- quando os desvios se anulam, o isômero é opticamente inativo.

Agora vamos ver como ocorrerão os desvios da luz nas misturas equimolares do par de enantiômeros, as misturas racêmicas.

Como o isômero meso também é opticamente inativo, concluímos que uma molécula com 2 CARBONOS QUIRAIS possui 4 IOA e 2 IOI, um dos quais é o MESO.
CUIDADO!
Cadeia Fechada
Quando a estrutura tiver cadeia fechada, da qual um carbono tenha 2 ligantes diferentes, ela pode ter atividade óptica, caso a sequência do sentido horário da cadeia ligada a tal carbono seja diferente da sequência do sentido anti-horário.
Exemplo:
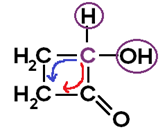
O carbono possui LIGANTES DIFERENTES entre si;
Sequência no sentido horário: (C=O)CH2CH2;
Sequência no sentido anti-horário: CH2CH2(C=O);
Como as 2 SEQUÊNCIAS são DIFERENTES, há isomeria óptica;
O número de IOA também será 2^{n}2;
O número de IOI também será 2^{n-1} ou 2^{n}/2.