Isomeria cis - trans
Isomeria cis – trans na cadeia aberta
Isomeria cis – trans na cadeia fechada
Exemplos de isomeria cis-tras em cadeias fechadas
Isomeria Geométrica ( E- Z )
Questão 1 – Nome oficial dos isômeros
Questão 2 – Quantidade de isômeros
O estudo da isomeria plana esclareceu-nos muito a respeito do motivo pelo qual compostos de mesma fórmula molecular possuem propriedades físicas e químicas diferentes, na medida em que mostrou a diferença entre a estrutura plana da cadeia desses compostos, chamados de isômeros.
No entanto, ficaram mais dúvidas sobre compostos que possuem tanto fórmulas moleculares como fórmulas estruturais planas iguais, contudo apresentam propriedades físicas e químicas diferentes. Assim, descobriu-se a existência de diferenças entre eles que apenas podem ser observadas em dimensões espaciais, e surgiu o que chamamos de isomeria espacial ou estereoisomeria.
Esse tipo de isomeria se divide entre GEOMÉTRICA ou CIS-TRANS (sobre a qual aprenderemos neste material) e ÓPTICA (a ser vista posteriormente).
A isomeria GEOMÉTRICA ou CIS-TRANS pode ocorrer em 2 tipos de compostos:
Cadeia aberta com ligação dupla:
Condições de ocorrência:
I. Ter ligação dupla na cadeia;
II. Possuir grupos radicais distintos no mesmo carbono da dupla, ou seja, R1 ≠ R2 e R3 ≠ R4.
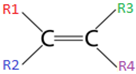
Nestes compostos, a ligação dupla impede a rotação entre os átomos de carbono, que existe quando a ligação entre eles é simples.
Exemplo1:
1,2-dicloroetano \rightarrow→ C_22H_44Cl_22
Ao girarmos um dos carbonos na molécula do 1,2-dicloroetano, a molécula continua a mesma, não altera sua conformação espacial nem suas propriedades.
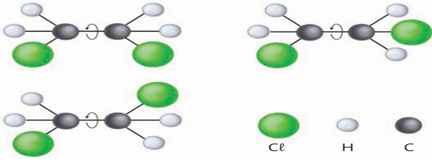
Exemplo 2:
Observe agora a molécula de 1,2-dicloroeteno abaixo:

Como a molécula do 1,2-dicloroeteno não possui essa livre rotação, devido à ligação dupla entre carbonos, motivo pelo qual as 2 estruturas abaixo já representam compostos diferentes, com propriedades físicas e químicas diferentes.
Já que se trata de compostos diferentes, recebem nomes diferentes, da seguinte maneira:
• CIS + nome do composto \rightarrow→ quando ligantes iguais estiverem do mesmo lado do plano espacial ou quando o ligante de menor número atômico de um dos carbonos estiver do mesmo lado do plano espacial que o ligante de menor número atômico do outro carbono.
• TRANS + nome do composto \rightarrow→ quando ligantes iguais estiverem em lados opostos do plano espacial ou quando o ligante de menor número atômico de um dos carbonos estiver no lado oposto ao do ligante de menor número atômico do outro carbono.
Utilizando o exemplo 2:
cis-1,2-dicloroeteno

Exemplo 3:
Exemplo 4:
Observação: O composto cis é aquele em que os hidrogênios estão para o mesmo lado, formando uma conformação espacial menos simétrica que na trans, em que os hidrogênios estão em lados opostos
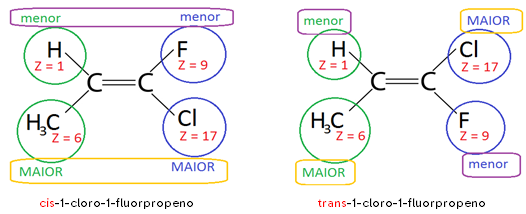
Importante à beça: A isomeria CIS-TRANS foi inicialmente designada para compostos em que R1=R4 e R2=R4 ou R1=R4 e R2=R3. Por isso, estabeleceu-se a ISOMERIA E-Z para indicar os casos em que não há igualdade entre ligantes de um e de outro carbono da dupla, da seguinte maneira:
Z + nome do composto 🡪 quando o ligante de menor número atômico de um dos carbonos estiver do mesmo lado do plano espacial que o ligante de menor número atômico do outro carbono.
E + nome do composto 🡪 quando o ligante de menor número atômico de um dos carbonos estiver no lado oposto ao do ligante de menor número atômico do outro carbono.
Exemplos:
Z-1-cloro-1-fluorpropeno e E-1-cloro-1-fluorpropeno
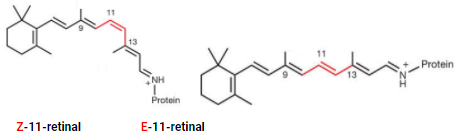
Z-11-retinal e E-11-retinal
No entanto, hoje em dia usamos mais a isomeria CIS-TRANS até mesmo para estes casos, como abordado inicialmente, sendo o isômero Z correspondente ao CIS e o E, ao TRANS.
Exemplo:
Cadeia fechada (Isomeria Bayeriana)
Condição de ocorrência
Em pelo menos dois átomos de carbono do ciclo, devemos encontrar dois grupos radicais distintos entre si.
Nestes compostos, o que impede a rotação entre os átomos de carbono é o fato de a cadeia ser fechada.
Exemplo 1:
Já que se trata de compostos diferentes, recebem nomes diferentes, da seguinte maneira:
CIS + nome do composto 🡪 quando ligantes iguais estiverem do mesmo lado do plano;
TRANS + nome do composto 🡪 quando ligantes iguais estiverem em lados opostos do plano espacial.

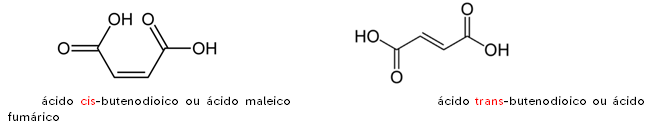
Exemplo 2:

Importante à beça:
Cis:
Menos estável 🡪 devido à existência de 2 radicais iguais do mesmo lado, seus pares eletrônicos se repelem com maior intensidade. Isso cria um momento dipolar diferente de zero, o que reduz sua estabilidade;
Menos simétrico;
MAIOR ponto de ebulição.
Trans:
Mais estável 🡪 devido à existência de 2 radicais iguais em lados opostos, seus pares eletrônicos se repelem com menor intensidade. Isso cria um momento dipolar igual a zero, o que aumenta sua estabilidade;
Mais simétrico;
MENOR ponto de ebulição.