Ligação de Van der Walls
Ligação Dipolo-Dipolo
Ligação de Hidrogênio
Solubilidade
Questão sobre geometria molecular e solubilidade
Forças intermoleculares
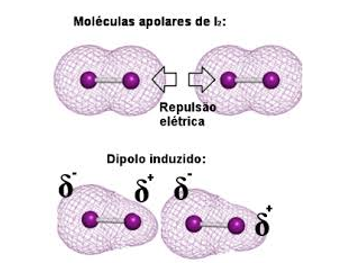
Dipolo induzido-dipolo induzido, van der Waals ou dipolo-induzido → Ocorre nas moléculas apolares.
Ex: H2 , O2 , CO2
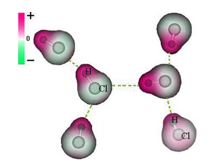
Dipolo permanente-dipolo permanente ou dipolo-dipolo → Ocorre nas moléculas polares.
Ex: HCl, HBr, HI, H2S
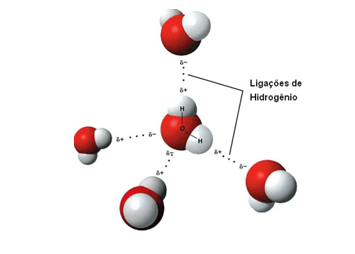
Ligação de Hidrogênio → Antes essa força era chamada de ponte de hidrogênio. As ligações de hidrogênio são atrações intermoleculares fortíssimas que ocorrem entre moléculas polares que apresentam ligações do Hidrogênio com átomos muito eletronegativos como o Flúor, Oxigênio e Nitrogênio.
Ex: HF, NH3 , H2O
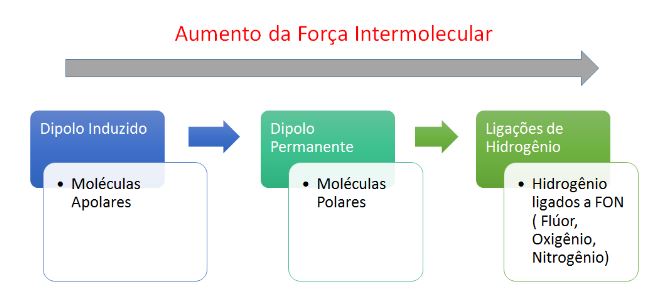
O aumento da força é proporcional aos pontos de fusão e ebulição dos compostos.
ATENÇÃO!
Ligação Íon-dipolo
A interação íon-dipolo envolve um íon e uma molécula polar, de forma que as cargas que possuam caráter atrativo se aproximam. Portanto, quanto maior a carga do íon relativamente ao dipolo, maior a intensidade da ligação (melhor será a atração).