Introdução à geometria molecular e polaridade
Moléculas com 2 átomos
Moléculas com 3 átomos
Moléculas com 4 átomos
Moléculas com 5 átomos
I - Polaridade
Polaridade das ligações
Ligação Iônica: Nas ligações iônicas, a transferência de elétrons é definitiva, formação de cátions(positivo) e ânions(negativo). As ligações iônicas são sempre POLARES.
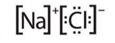
Ligação Covalente: Nas ligações formadas por átomos com a mesma eletronegatividade, não há formação de polos pois essa diferença é igual a zero. Formando ligação covalente apolar.
Exemplo: Cl2
(Cl – Cl) → ∆en = 3,0 – 3,0 → ∆en = 0
Nas ligações formadas por átomos com diferentes eletronegatividades, há formação de polos pois essa diferença é diferente de zero. Formando ligação covalente polar.
Exemplo: HBr
(H – Br) → ∆en = 2,8 – 2,1 → ∆en = 0,7
Polaridade das moléculas
As moléculas podem ser classificadas em moléculas polares e apolares, dependendo do vetor de momento dipolo da molécula ser anulado ou não.

Exemplo:
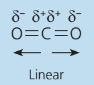
CO2
Os vetores possuem a mesma diferença de eletronegatividade por serem entre os mesmos alementos, e possuem a mesma direção e sentidos opostos, fazendo com que se anulem e o momento dipolo seja igual a zero.
H2O
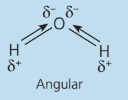
O oxigênio da água possui dois pares de elétrons que não se ligam a nada, logo esses pares empurram as ligações O-H para baixo, formando assim um ângulo entre eles, os vetores não se anulam como na molécula de CO_2CO2. O momento dipolo nesse caso é diferente de zero.
II - Geometria Molecular
Na determinação da geometria de uma molécula devemos seguir alguns passos, são eles:
• Determinar o átomo central, geralmente, o elemento em menor quantidade tende a ser o elemento central na estrutura do composto;
• Determinar o número de elétrons na camada de valência dos átomos participantes;
• Determinar as ligações, mostrando os pares de eletrons ligantes e não ligantes.
• Determinar se há ou não repulsão entre os pares de elétrons ligantes e não ligantes para formação da geometria molecular.
a) Linear
Formada por molécula triatomicas, onde o elemento central não possui par de elétrons não ligantes sobrando.
Ex.: BeH2
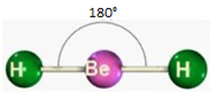
Obs: Toda substância com 2 elementos tem geometria linear e não existe átomo central.
Ex.: HCl

b) Angular
Formada por moléculas que possuem 2 átomos ligados aos elementos centrais, onde o elemento central possui par de elétrons não ligantes sobrando.
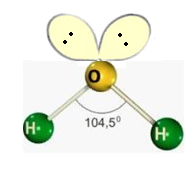
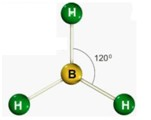
c) Trigonal plana
Formada por moléculas que possuem 3 átomos ligados aos elementos central, onde o elemento central não possui par de elétrons não ligantes sobrando.
Ex.: BF3
d) Piramidal
Formada por moléculas que possuem 3 átomos ligados aos elementos central, onde o elemento central possui par de elétrons não ligantes sobrando causando repulsão.
Ex.: NH3
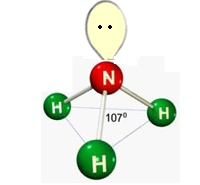
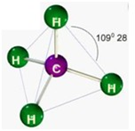
e) Tetraédrica
Formada por moléculas que possuem 4 átomos ligados ao elemento central, onde o elemento central não possui par de elétrons não ligantes sobrando.
Ex.: CH4