Exercício 1
Exercício 2
Exercício 3
Exercício 4
Exercício 5
Exercício 6
Concentração comum (C)
A definição mais simples é:
Concentração é a quantidade, em gramas, de soluto existente em 1 litro de solução.
C = m / V(L)
Exemplo: Qual a concentração comum de uma solução preparada com 20 gramas de NaCl sólido e 400 mL de água?
400 ml = 0,4 L
C = m1/v = 20 / 0,4 = 50 g/L
Importante!
É normal confundir coma expressão da densidade que é muito parecida, porém, atente-se as diferenças conceituais:

A densidade da solução relaciona, portanto, a massa com o volume da própria solução. Ela indica a massa da solução correspondente a uma unidade de volume (por exemplo: 1 mililitro).
Exemplo: Qual a densidade da solução preparada com 50 gramas de NaCl e 150 gramas de água?
Massa da solução = 50 gramas NaCl + 150 gramas de água = 200 gramas
Volume da solução = 150 gramas de água = 150 mL de água
d = m/v = 200 / 150 = 1,33 g/mL
Concentração em mols por litro ou molaridade (M)
Até aqui vimos a concentração comum. Nelas aparecem massas (em mg, g, kg, etc.) ou volumes (em mL, L, m3 etc). Essas concentrações são muito usadas na prática, no comércio, na indústria, etc. Vamos agora estudar outras formas de concentração, nas quais a quantidade do soluto é expressa em mols.
Concentração em mols por litro ou molaridade (M) da solução é a quantidade, em mols, do soluto existente em 1 litro de solução.
Matematicamente, a concentração é mol é expressa por:

Onde o número de mol (n) pode ser encontrado pela expressão:

Sendo assim podemos concluir que:
M = m1 / (MM . V)
Título ou percentuais (m/m, v/v e m/v)
Título em massa (%m/m)
Imagine uma solução formada por 20 g de cloreto de sódio e 80 g de água. A massa total será: 20 g +80 g = 100 g de solução. Assim, podemos dizer que:
20/100 = 0,2 % é a fração da massa total que corresponde ao NaCl
80/100 = 0,8% é a fração da massa total que corresponde ao H2O.
A fração em massa do soluto costuma ser chamada de título em massa da solução (T). Assim, definimos:
Título em massa de uma solução (T) é o quociente entre a massa do soluto e a massa total da solução (soluto + solvente).
Título em volume (%v/v) ou Graus Gay-Lussac
Às vezes aparece nos exercícios o título em volume ou a correspondente porcentagem volumétrica de uma solução. As definições são idênticas às anteriores, apenas trocando-se as palavras massa por volume. Isso acontece, por exemplo, em soluções líquido-líquido (dizemos, por exemplo, álcool a 96% quando nos referimos a uma mistura com 96% de álcool e 4% de água em volume).
Exemplo:
A análise de um vinho revelou que ele contém 18 mL de álcool em cada copo de 120 mL. Qual é o título em volume desse vinho?
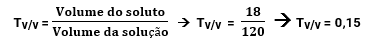
Ou seja, corresponde a 15% de álcool, em volume.
Título em massa/volume (%m/v)
Às vezes aparece nos exercícios o título em massa por volume ou a correspondente porcentagem em massa do soluto e volumétrica da solução. As definições são idênticas às anteriores. Isso acontece, por exemplo, em soluções sólido-líquido.
Exemplo:
NaCl a 10% m/v quando nos referimos a uma mistura com 10g de NaCl em 100mL de água.
Partes por milhão (ppm)
Além da concentração comum, do título e da molaridade, existem muitas outras maneiras de expressar a concentração de uma solução. Uma delas é o da concentração expressa em partes por milhão (ppm). É usada para soluções extremamente diluídas, ou seja, que apresentam uma quantidade de soluto muito pequena dissolvida em uma quantidade muito grande de solvente (ou de solução). Por exemplo, sabemos que a qualidade do ar atmosférico se torna inadequada quando há mais de 0,000015 g de monóxido de carbono (CO) por grama de ar. Como o uso desse valor pequeno dificulta na hora de fazer certos cálculo, expressamos a seguinte relação:

Assim chegamos a conclusão que 15 partes de CO em 1 milhão de partes do ar ou 15 ppm de CO no ar. Como a comparação foi feita entre massa (gramas de CO) e massa (gramas de ar), costuma-se especificar ppm(m /m). Essa notação evita a confusão entre comparações semelhantes, mas feitas entre massa e volume (m /v), volume e volume (v/v), etc. Análogo ao conceito de ppm é o de partes por bilhão (ppb), no qual a comparação é feita entre 1 parte e 1 bilhão (10^99) de partes.
Relação entre unidades (molaridade, densidade, título e massa molar)
C = M.MM = 10.%.d
Onde:
C= Concentração comum (g/L)
M = Molaridade (mol/L)
MM = massa molar do soluto (g/mol)
% = título em massa
d = densidade (g/mL)