Questão 1 - Lei de Hess e cálculo da entalpia
Questão 2 - decomposição térmica de compostos orgânicos
Questão 3 - Formação do acetaldeído
Questão 4 - Formação do propano e sua entalpia
Questão 5 - Entalpia da esterificação
Questão 6 - Entalpia da síntese da amônia
Lei de Hess
Em meados do século XIX o químico Germain Hess descobriu que a variação de entalpia (ΔH) de uma reação química dependia apenas do estado inicial e do estado final da reação.
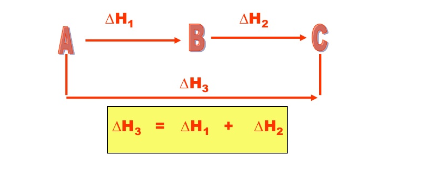
Observe que a entalpia envolvida na transformação de A para C independe se a reação foi realizada em uma única etapa (A→C), ou em várias etapas(A→B→C).
A partir deste conceito chegamos à conclusão de que é possível calcular a variação de entalpia de uma reação através dos calores das reações intermediárias.
Exemplo:
A reação de combustão completa do carbono é representada por:
C+ O2 → CO2
ΔHglobal = ?
Sendo esta a sua reação global com valor de ΔH desconhecido. Porém, sabemos que está equação acontece em duas etapas:
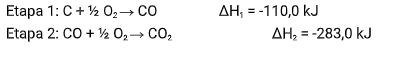
Portanto, conhecendo os valores de ΔH das reações intermediárias, é possível chegar ao valor de ΔH da nossa equação global, somando estas equações intermediárias e cortando os reagentes com produtos
iguais de reações distintas:
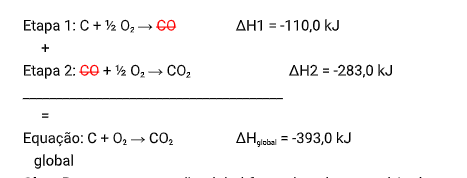
OBS1.: Repare que a reação global formada pelo somatório das etapas tem que ser idêntica a reação global dada pela questão.
OBS2: Caso algumas das reações sejá invertida, é necessario alterar o sinal do ΔH. E caso a reação sejá multiplicada do dividida, deve-se multiplicar o dividir o ΔH também.
Entalpia de Ligação
Imagine dois átomos ligados e no estado gasoso. A quebra da ligação que une estes dois átomos sempre envolverá absorção de energia, e a união destes dois átomos sempre envolverá liberação de energia.
Os processos de união e quebra são opostos, mas sempre envolverão a mesma quantidade de energia quando estivermos falando da mesma ligação. A energia de ligação é a energia necessária para quebrar 1 mol de ligações no estado gasoso.
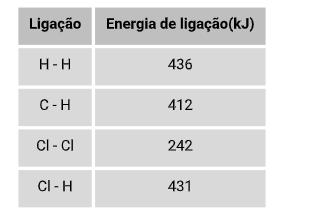
Sendo assim, é possível determinar a variação de entalpia de qualquer reação se forem conhecidas as energias de todas as ligações nas substâncias envolvidas. Basta escrever a reação em duas etapas:
- Quebra de todas as ligações dos reagentes, com variação de entalpia igual à soma de todas as
energias de ligação;
- Formação das ligações dos produtos, desta vez liberando a energia correspondente à soma das
energias de ligação dos produtos.
- A soma das variações de entalpia nestas duas etapas fornecerá a variação de entalpia global da reação
completa.
PSIU!!
- Ligação dos reagentes é quebrada = absorve calor, sinal positivo.
- Ligação dos produtos é formada = libera calor, sinal negativo.
Exemplo 1:
Energia de ligação do composto CH4
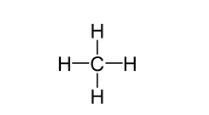
4.(C - H) = 4 . 412 = 1648 kJ
Exemplo 2:
Qual a variação de entalpia(ΔH) da reação abaixo?
H2 + Cl2 → 2 HCl
