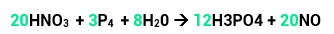Exercício 1 – Tipos de Reações Inorgânicas
Exercício 2 – Identificando os tipos de reações inorgânicas
Exercício 3 – Comparação da reatividade dos elementos
Exercício 4 – Oxidação do ouro
Exercício 5 – Reatividade dos ametais
Exercício 6 – Método de oxirredução
Exercício 7 – Balanceamento por tentativas pelo método de oxirredução
As reações químicas são processos que transformam uma ou mais substâncias, chamados reagentes, em outras substâncias, chamadas produtos.
Na química inorgânica podemos classificar as reações em quatro tipos diferentes:
Adição ou síntese
As reações de adição ou síntese são aquelas onde substâncias se juntam formando uma única substância.
Síntese total
Somente substâncias simples no reagente
Ex.: C + O2 → CO2
S + 3/2 O2 + H2O → H2SO4
Síntese parcial
Pelo menos uma substância composta nos reagentes.
Ex.: SO2 + 1/2 O2 → SO3
CaO + H2O → Ca(OH)2
Decomposição ou análise
As reações de decomposição ou análise são aquelas onde uma substância dá origem a duas ou mais substâncias.
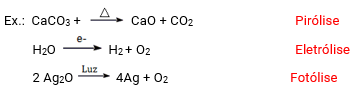
Simples troca ou deslocamento
As reações de simples troca ou deslocamento são aquelas onde existe a substituição do cátion ou do ânion de uma substância por um novo cátion ou ânion derivado de uma substância simples.

Ex.: Deslocamento do cátion:
Ocorre: CuCl2 + Zn → ZnCl2 + Cu
O Zn é mais reativo que o Cu, portanto, consegue substituí-lo no CuCl2.
Não ocorre: KBr + Hg → X
O Hg é menos reativo que o K, portanto, não consegue substituí-lo no KBr.
Tabela de reatividade dos metais:

Deslocamento do ânion:
Ocorre: 2 KBr + Cl2→ 2 KCl + Br2
O Cl é mais reativo que o Br, portanto, consegue substituí-lo no KBr.
Não ocorre: 2NaCl + I2 → X
O I é menos reativo que o Cl, portanto, não consegue substituí-lo no NaCl.
Tabela de reatividade dos ametais:
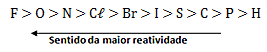
Dupla troca ou permutação
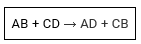
As reações de dupla troca ou permutação são aquelas que ocorrem entre substâncias compostas, havendo uma troca de espécies químicas que resulta na formação de novas substâncias compostas.
Ex.: AgBr + Al+S3 → AlBr3 + Ag2S
O cátion Ag+ do AgBr se liga ao ânion S−2 do Al2S3, e o cátion Al+3 do Al2S3 se liga ao Br- do AgBr.
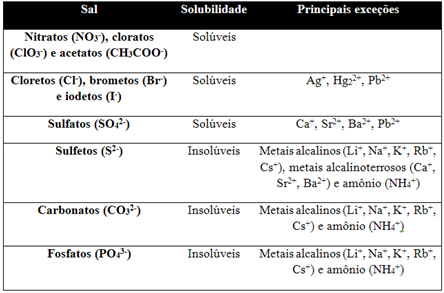
Obs.: Condições para ocorrência das reações de dupla troca
Formação de eletrólitos fracos
Na2S + H2SO4 → H2S (eletrólito fraco) + Na2SO4
Formação de gás
CaCO3 + HCl → H2O + CO2(gás) + CaCl2
Formação de precipitado
AgNO3 + NaCl → AgCl(precipitado - sólido) + NaNO3
Tabela de solubilidade
Balanceamento pele método da oxidorredução
O método das tentativas em algumas reações redox não é muito prático, veja um passo-a-passo de como equilibrar esse tipo de reação:
1 -Determinar o nox dos elementos na equação;
2 - Identificar os elementos que sofreram oxidação e redução, encontrando a variação de nox de cada um (ex.: se um elemento tinha nox +2 e passou para +4, sua variação será igual a 2).
3 - Multiplicar o valor de cada variação encontrada pelo número de átomos dos elementos que sofreram a variação.
Obs1: Se os valores forem múltiplos (ex.: 9 e 6), devemos simplificá-los (9÷3, 6÷3).
4 - O valor da variação total do elemento que sofreu oxidação deve ser transportado para onde houve redução e vice-versa.
Obs2: A substância que deve receber o coeficiente é aquela que possui o maior número de átomos que efetivamente se oxidaram ou reduziram.
5 - Terminar o balanceamento pelo método da tentativa.
Veja o exemplo:
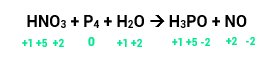
O nox do nitrogênio era +5 e diminuiu para +2, ou seja, ele reduziu e sua variação será de 3.
O nox do fósforo era 0 e aumentou para +5, portanto, ele oxidou. Sua variação será de 5.
Temos 1 átomo de N, então, 1 x 3 = 3 (variação total).
Temos 4 átomos de P, então, 4 x 5 = 20 (variação total).
Agora é só colocar a total do N na frente do P que tiver maior número de átomos e a total do P na frente do N que tiver maior número de átomos (como, neste caso, o N dos reagentes tem o mesmo número do N dos produtos, colocamos o coeficiente na frente dos dois). Teremos, então:
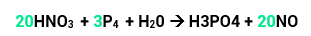
Por fim faremos o balanceamento pelo método das tentativas.Se temos 12 P nos reagentes, devemos ter o mesmo nos produtos. Para isso, vamos colocar 12 na frente do H3PO4. Por fim, ficamos com 68 átomos de O nos produtos, clocando o 8 na frente da água igualamos as quantidades de oxigênio tanto nos produtos quanto nos reagentes. Pronto, sua equação já está balanceada.