Determinação do ácido mais forte
Força de ácidos orgânicos
Conceitos fundamentais de química orgânica
Conceitos de saponificação
Nomenclatura, acidez e reações orgânicas
Caráter básico de compostos orgânicos
Basicidade e solubilidade de compostos orgânicos
Propriedades de compostos orgânicos
Considerações sobre ácidos orgânicos
Ponto de fusão e ebulição dos compostos orgânicos
Interações Intermoleculares
As forças intermoleculares são as forças que ocorrem entre uma molécula e a molécula vizinha. Durante uma mudança de estado físico ocorre o afastamento ou a aproximação entre essas moléculas, rompendo ou formando ligações intermoleculares. As forças intermoleculares podem ser do tipo: Dipolo induzido, Dipolo-dipolo ou ligação de hidrogênio. Quanto mais fortes forem as forças intermoleculares entre as moléculas, mais será o ponto de fusão e ebulição da substância, pois mais difícil será de afastar uma molécula da sua molécula vizinha.
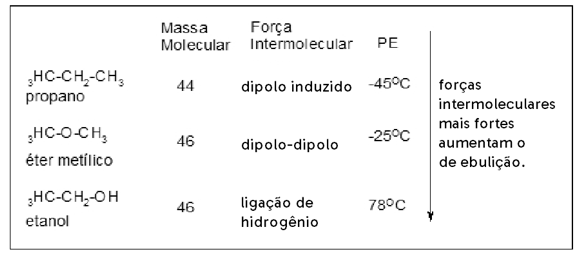
PSIU!
Os hidrocarbonetos ramificados possuem menor extensão para ação das forças intermoleculares, portanto para hidrocarbonetos de mesma fórmula molecular, os menos ramificados possuem maior ponto de ebulição.
Ex.: C5H12
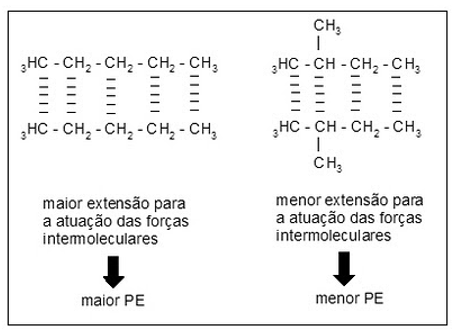
Veja que o hidrocarboneto ramificado possui menor ponto de ebulição que o hidrocarboneto não ramificado de mesma fórmula molecular.
Massa molar
Quanto maior for a massa molar do composto, maior será o seu ponto de ebulição.
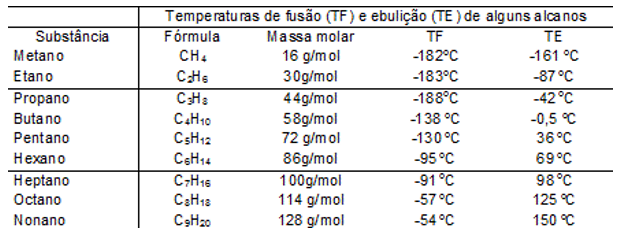
Solubilidade dos compostos orgânicos
A solubilidade dos compostos orgânicos deve ser analisada a partir da polaridade e/ou apolaridade exercida pela sua estrutura molecular.
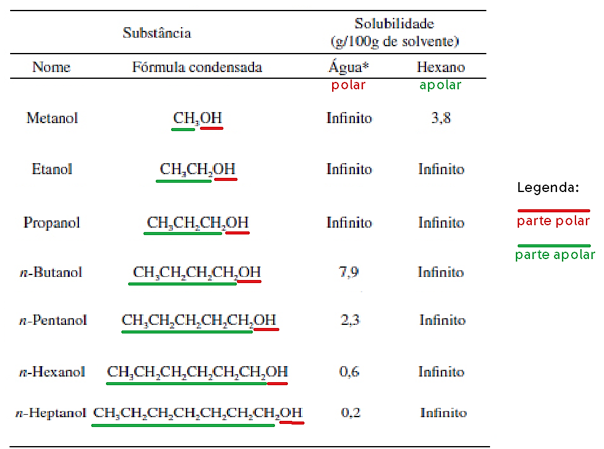
Sendo assim, é possível visualizar que com o aumento da parte apolar do hidrocarboneto há o aumento da solubilidade em hexano, que é um composto apolar. E a diminuição da solubilidade em água, que é um composto polar.
Vale lembrar, que o aumento da quantidade de hidroxilas (-OH), elevaria a polaridade da molécula, aumentando a solubilidade em água e diminuindo a solubilidade em hexano.