Questão 1 - Le Chatelier e fotossíntese
Questão 2 - Consequências da alteração de equilíbrio
Questão 3 - Le Chatelier e análise cinética e termoquímica
Questão 4 - Le Chatelier e mudança de cor da solução
Questão 5 - Le Chatelier e termoquímica
Questão 6 - Le Chatelier e gráfico de concentrações
Questão 7 - Análise de vários sistemas em equilíbrio
Princípio de le chatelier
Sabemos que um sistema que se encontra em equilíbrio – após ter alcançado a igualdade para as velocidades do sentido direto e inverso – tende a permanecer nessa situação. No entanto, quando algum agente externo exerce sua interferência sobre o tal sistema, gerando uma perturbação que o tire da situação de equilíbrio – isto é, faz com que um sentido da reação adquira velocidade maior que a de outro sentido –, o próprio sistema se encarrega de minimizá-la, a fim de voltar ao equilíbrio. Como ele faz isso? Deslocando a reação para um dos sentidos.
A essa “reação” do sistema às perturbações externas, os cientistas deram o nome de Princípio de Le Chatelier, haja vista que foi Henri Louis Le Chatelier, em 1884, quem cunhou o enunciado de tal princípio.
Mas quais são as ações ou perturbações externas que afetam o equilíbrio dos sistemas? A resposta é: concentração, pressão e temperatura.
IMPORTANTE À BEÇA:
Dos fatores citados acima, o único que tem a capacidade de alterar o valor da constante de equilíbrio (Kc) é a temperatura.
Concentração
Influências básicas:
Ao aumentarmos a concentração de um composto, o equilíbrio se desloca no sentido de consumir este composto. Ou seja, se aumentamos a quantidade de um reagente, o equilíbrio se desloca no sentido direto, para diminuir a concentração desse reagente; já se aumentamos a quantidade de um produto, o equilíbrio se desloca no sentido inverso, para diminuir a concentração desse produto. Ainda em outras palavras, ao se aumentar a concentração de um composto da reação, o equilíbrio se desloca pro lado oposto da seta.
Pressão
Em primeiro lugar, precisamos ter em mente que o fator pressão só influi sobre equilíbrios gasosos, e nos lembrar que a relação entre pressão e volume é íntima e inversa (são inversamente proporcionais). Ou seja, quando aumentamos a pressão sobre um sistema gasoso, seu volume diminui. Já se diminuímos a pressão sobre ele, seu volume aumenta.
Ao aumentarmos a pressão de um sistema em equilíbrio, o equilíbrio se desloca para o lado de menor volume.
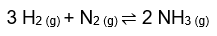
No sistema gasoso em equilíbrio acima, a reação direta produz 2 mols de gás; já a reação inversa produz 4 mols de gás, no total (3 mols de H2 + 1 mol de N2). Em determinado volume, este sistema mantém cada um desses gases em concentração adequada ao espaço que ocupam (e isso constantemente, por estar em situação de equilíbrio).
Assim, quando comprimimos este recipiente, seu volume diminui, e as concentrações preexistentes precisam se alterar para que o conjunto dos gases caiba no novo e menor espaço. É óbvio que a nova conformação exige um volume menor de gases. Para tanto, o equilíbrio terá de se deslocar para formar uma quantidade de gases que ocupem menos espaço do que o que havia antes, e a saída terá que ser o deslocamento no sentido direto, o que forma apenas 2 mols de gás.
Temperatura
Influências básicas:
Ao aumentarmos a temperatura de um sistema, o equilíbrio se desloca no sentido da reação endotérmica, ou seja, a que absorve calor mais do que libera, para formar produtos.
Ao diminuirmos a temperatura de um sistema, o equilíbrio se desloca no sentido da reação exotérmica, ou seja, a que libera calor mais do que absorve, para formar produtos.