Exercício 1 – Geometria molecular para moléculas com 4 e 5 átomos
Exercício 2 – geometria molecular com moléculas com 3, 4 e 5 átomos
Exercício 3 – geometria molecular e polaridade das moléculas
Exercício 4 – geometria molecular, polaridade e reações químicas
Exercício 5 – polaridade, geometria molecular e solubilidade
Exercício 6 – hidretos e ponto de ebulição
Exercício 7 – solubilidade e interações intermoleculares
I - Polaridade
Polaridade das ligações
Ligação Iônica: Nas ligações iônicas, a transferência de elétrons é definitiva, formação de cátions(positivo) e ânions(negativo). As ligações iônicas são sempre POLARES.
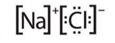
Ligação Covalente: Nas ligações formadas por átomos com a mesma eletronegatividade, não há formação de polos pois essa diferença é igual a zero. Formando ligação covalente apolar.
Exemplo: Cl2
(Cl – Cl) → ∆en = 3,0 – 3,0 → ∆en = 0
Nas ligações formadas por átomos com diferentes eletronegatividades, há formação de polos pois essa diferença é diferente de zero. Formando ligação covalente polar.
Exemplo: HBr
(H – Br) → ∆en = 2,8 – 2,1 → ∆en = 0,7
Polaridade das moléculas
As moléculas podem ser classificadas em moléculas polares e apolares, dependendo do vetor de momento dipolo da molécula ser anulado ou não.

Exemplo:
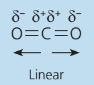
CO2
Os vetores possuem a mesma diferença de eletronegatividade por serem entre os mesmos alementos, e possuem a mesma direção e sentidos opostos, fazendo com que se anulem e o momento dipolo seja igual a zero.
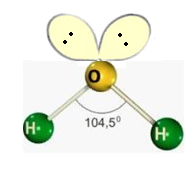
H2O
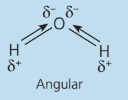
O oxigênio da água possui dois pares de elétrons que não se ligam a nada, logo esses pares empurram as ligações O-H para baixo, formando assim um ângulo entre eles, os vetores não se anulam como na molécula de CO_2CO2. O momento dipolo nesse caso é diferente de zero.
II - Geometria Molecular
Na determinação da geometria de uma molécula devemos seguir alguns passos, são eles:
• Determinar o átomo central, geralmente, o elemento em menor quantidade tende a ser o elemento central na estrutura do composto;
• Determinar o número de elétrons na camada de valência dos átomos participantes;
• Determinar as ligações, mostrando os pares de eletrons ligantes e não ligantes.
• Determinar se há ou não repulsão entre os pares de elétrons ligantes e não ligantes para formação da geometria molecular.
a) Linear
Formada por molécula triatomicas, onde o elemento central não possui par de elétrons não ligantes sobrando.
Ex.: BeH2
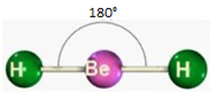
Obs: Toda substância com 2 elementos tem geometria linear e não existe átomo central.
Ex.: HCl

b) Angular
Formada por moléculas que possuem 2 átomos ligados aos elementos centrais, onde o elemento central possui par de elétrons não ligantes sobrando.
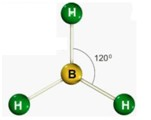
c) Trigonal plana
Formada por moléculas que possuem 3 átomos ligados aos elementos central, onde o elemento central não possui par de elétrons não ligantes sobrando.
Ex.: BF3
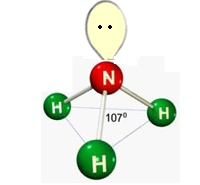
d) Piramidal
Formada por moléculas que possuem 3 átomos ligados aos elementos central, onde o elemento central possui par de elétrons não ligantes sobrando causando repulsão.
Ex.: NH3
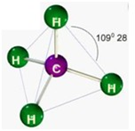
e) Tetraédrica
Formada por moléculas que possuem 4 átomos ligados ao elemento central, onde o elemento central não possui par de elétrons não ligantes sobrando.
Ex.: CH4
III - Forças intermoleculares
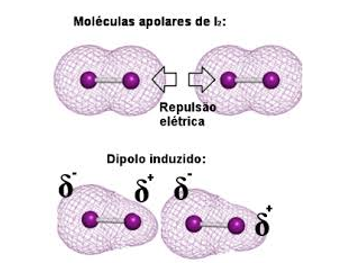
Dipolo induzido-dipolo induzido, van der Waals ou dipolo-induzido → Ocorre nas moléculas apolares.
Ex: H2 , O2 , CO2
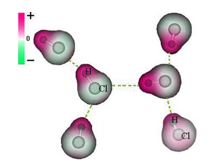
Dipolo permanente-dipolo permanente ou dipolo-dipolo → Ocorre nas moléculas polares.
Ex: HCl, HBr, HI, H2S
Ligação de Hidrogênio → Antes essa força era chamada de ponte de hidrogênio. As ligações de hidrogênio são atrações intermoleculares fortíssimas que ocorrem entre moléculas polares que apresentam ligações do Hidrogênio com átomos muito eletronegativos como o Flúor, Oxigênio e Nitrogênio.
Ex: HF, NH3 , H2O
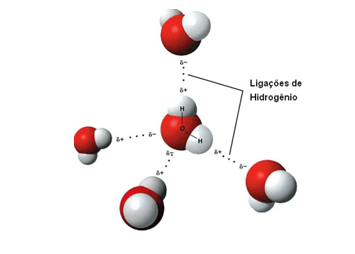
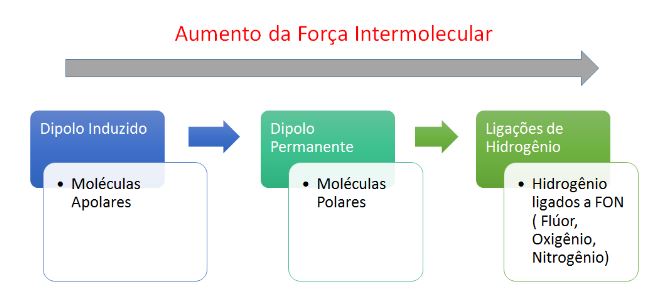
O aumento da força é proporcional aos pontos de fusão e ebulição dos compostos.
ATENÇÃO!
Ligação Íon-dipolo
A interação íon-dipolo envolve um íon e uma molécula polar, de forma que as cargas que possuam caráter atrativo se aproximam. Portanto, quanto maior a carga do íon relativamente ao dipolo, maior a intensidade da ligação (melhor será a atração).