Exercício 1 – Ligações iônicas em óxidos e nº de oxidação
Exercício 2 – Distribuição eletrônica e tabela periódica
Exercício 3 – Fórmula mínima e tipos de ligações
Exercício 4 – Tabela periódica e ligações covalentes
Exercício 5 – Caráter covalente em compostos iônicos
Exercício 6 – Elétrons de valência e estrutura de Lewis
Exercício 7 – Características da ligação metálica
Exercício 8 – Tabela periódica e ligação iônica
Exercício 9 – Propriedade das ligações químicas
Exercício 10 – Formação das ligações químicas
Ligação iônica
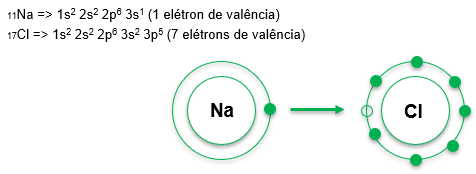
Na ligação iônica, os elétrons são transferidos de um átomo com tendência a doar (metais) para um átomo com tendência a perder elétrons (ametais ou hidrogênio). Após a transferência, formam-se íons e estes se ligam por força eletrostática.
A diferença de eletronegatividade é, em geral, maior que 1,7 em ligações iônicas.
Exemplos:
Na e Cl
Principais características
Átomos dispostos em uma estrutura chamada retículo cristalino;
Sólidos em temperatura ambiente;
Apresentam elevada dureza;
Apresentam baixa tenacidade;
Possuem elevados pontos de fusão e ebulição;
Conduzem corrente elétrica quando em solução;
Conduzem energia elétrica nos estados líquido e gasoso.
Ligação Covalente
Esse tipo de ligação se dá por compartilhamento de um par de elétrons, sendo um elétron de cada átomo ou os dois elétrons do mesmo átomo. Há formação de moléculas, logo, esta ligação é também chamada de molecular. Ele acontece entre ametais ou entre o hidrogênio e um ametal, e entre hidrogênios. A diferença das eletronegatividades dos átomos envolvidos, geralmente, é menor que 1,7.
Quando a diferença das eletronegatividades dos átomos envolvidos for igual a zero (∆en = 0), dizemos que a ligação covalente tem caráter apolar e quando a diferença das eletronegatividades for diferente de zero (∆en ≠ 0), dizemos que o caráter da ligação covalente é polar.
Exemplo:
O2
Eletronegatividade: O = 3,5
Δen: 3,5 - 3,5 = 0 → ligação covalente apolar
NH3
Eletronegatividades: N = 3,0 H = 2,1
Δen: 3,0- 2,1 = 0,9 → ligação covalente polar
Principais características de compostos moleculares
Pontos de fusão e ebulição baixos.
À temperatura ambiente podem apresentar-se nos estados: sólido, líquido ou gasoso.
Não são bons condutores de corrente elétrica em solução aquosa. Porém alguns ácidos fortes, por exemplo, em meio aquoso sofrem ionização (formação de íons), tornando a solução condutora de corrente elétrica.
Pontos de fusão e de ebulição menores que os dos compostos iônicos (as forças entre moléculas são menores porque não há a atração elétrica provocada pelos íons).
Pouca solubilidade em água.
Tendem a ser mais inflamáveis que os compostos iônicos (carbono e hidrogênio queimam facilmente e são encontrados em grande parte dos compostos covalentes).
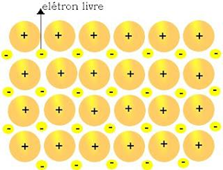
Ligação Metálica
Em materiais com este tipo de ligação, os elétrons se movem livremente (“mar de elétrons”) pelos átomos de metal da estrutura. Este é o motivo da alta condutividade dos metais e da sua aplicabilidade em circuitos elétricos.
Ligas metálicas são formadas por dois ou mais metais ou um metal com um ametal em quantidade pequena.