Exercício de Capacidade térmica
Exercício de gráfico TxQ
Exercício de Potência térmica
Exercício de gráfico com mudança de fase
Exercício de troca de calor
Exercício de troca de calor com gráfico
Exercício de troca de calor com mudança de estado
Exercício de troca de calor com mudança de fase usando gráfico
Calorimetria
Calor é definido com um processo de transferência espontânea de energia da região de maior temperatura (maior concentração de energia cinética média por partícula) para a região de menor temperatura (menor concentração de energia cinética média por partícula).
Capacidade Térmica (C)
A capacidade térmica de um objeto é o quanto deve ceder ou receber de energia por calor para variar a temperatura do objeto. Também pode ser o produto da massa do corpo vezes o calor específico do material que o constitui. Assim, temos:
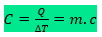
A unidade de capacidade térmica é cal/°C, ou no Sistema Internacional, J/K. Já a unidade de calor específico é cal/g°C, que no SI é J/g.K. É muito comum o uso da caloria como unidade fora do SI.
Para a conversão entre Calorias e Joule utilizamos: 1 cal ≈ 4,2 J.
A quantidade de calor calculada dessa maneira é denominada calor sensível. Dessa forma, temos que:
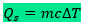
Onde:
- m: massa do corpo
- c: calor específico
- ΔT: variação de temperatura
Em algumas situações, você pode fornecer calor para um sistema sem aumentar em nada sua temperatura. Isto normalmente ocorre durante uma mudança de estado físico (mudança de fase), como o gelo derretendo ou a água fervendo. Tecnicamente, a capacidade térmica fica mal definida, já que você estaria dividindo por zero o calor! No entanto, ainda é interessante saber a quantidade de calor necessária para derreter ou ferver uma substância completamente. Esta quantidade de calor dividida pela massa da substância é chamada de calor latente da transformação, e é denotada por L:
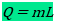
Um diagrama importante relaciona a temperatura de um objeto com o calor fornecido a ele (calor fornecido é positivo; calor cedido é negativo)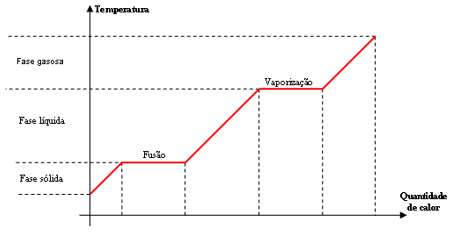
Começando na fase sólida, o corpo absorve calor a partir de uma fonte externa (fogão por exemplo) e aumenta de temperatura até chegar na temperatura de fusão. Nesse estágio, a temperatura do corpo não varia e todo calor absorvido (calor latente) é usado para quebrar ligações químicas (estamos numa mudança de fase). Logo em seguida a temperatura aumenta de novo até atingir a temperatura de vaporização e a análise se repete.