Transformações endo e exotérmicas
Entalpia e sua representação gráfica
Quantidades dos reagentes e o estado físico influem na variação de entalpia
Temperatura, pressão e estado alotrópico
Questão da UERJ que compara poder calorífico de alguns combustíveis
Termoquímica
Conceitos gerais
A maior parte das transformações físicas e químicas envolvem perda ou ganho de calor, e ele é sem dúvida a forma mais comum de energia que acompanha as reações químicas. E isso acaba resultando a importância do estudo do calor das reações na físico-química, denominamos termoquímica.
Termoquímica é o estudo das quantidades de calor liberadas ou absorvidas durante as reações químicas.
Para a Termoquímica, as reações químicas se classificam em:
1) Reações exotérmicas (∆H < 0): São as que produzem ou liberam calor, como por exemplo:
A queima do carvão:
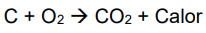
2) Reações endotérmicas (∆H > 0): São as que absorvem calor, como por exemplo:
A decomposição do carbonato de cálcio:
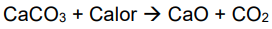
Gráficos termoquímicos
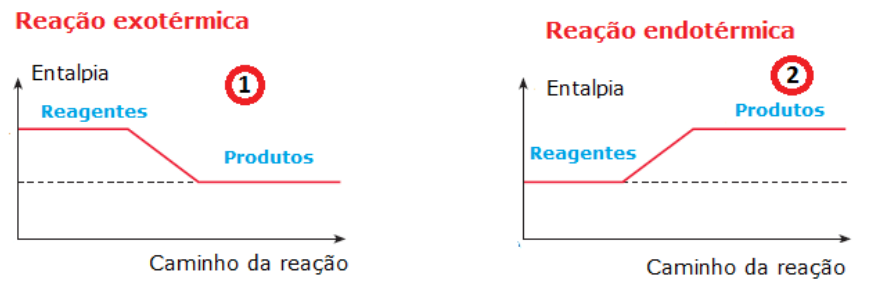
Vemos que o gráfico 1 representa uma reação exotérmica, ou seja, identificamos que a energia dos produtos é menor que a energia dos reagentes, logo houve uma liberação de calor. Em contrapartida, no gráfico 2 percebemos que a energia do produtos é maior do que a energia dos reagentes, logo, houve uma absorção de calor por parte dos reagentes.
Entalpia de formas alotropicas
Na termoquímica costumamos escutar a seguinte afirmativa: “Substâncias simples possuem entalpia de formação igual a zero no seu estado padrão”, mas temos que tomar muito cuidado com tal afirmação. Pois se convencionou que tem entalpia de formação igual a zero somente as substâncias simples que estão no seu estado alotropico mais estavel. É válido lembrar que é impossível calcular o valor absoluto das entalpias de
cada substância, mas é possível calcular a variação da entalpia que ocorre na reação, por meio de um calorímetro.
Átomos de um mesmo elemento químico podem formar diferentes substâncias simples, isso pode ocorre por dois motivos, o primeiro chamamos de alotropia por atomicidade, quando o mesmo elemento químico forma substâncias simples com diferentes quantidades de átomos, por exemplo: